Eine Diabeteserkrankung geht mit einem erhöhten kardiovaskulären Risiko einher. Die multifaktorielle Therapie der vier Hauptrisikofaktoren Blutzucker, Gewicht, Hypertonie und Dyslipidämie bei Personen mit Typ-2-Diabetes stellt eine Herausforderung dar. Es hat sich aber gezeigt, dass Diabetiker von modernen Behandlungsmöglichkeiten sehr profitieren können. Für die Lipidsenkung stehen mit Ezetimib und PCSK-9-Inhibitoren effektive «add-on» Therapieoptionen zur Verfügung. Studiendaten belegen, dass PCSK-9-Hemmer bei Patienten mit und ohne Diabetes zu einer zusätzlichen Lipidsenkung beitragen.
Bei erwachsenen Diabetikern ist das Risiko, ein kardiovaskuläres Ereignis wie einen ischämischen Schlaganfall oder einen nicht-tödlichen Myokardinfarkt zu erleiden, zwei- bis viermal höher als bei Gesunden und kardiovaskuläre Erkrankungen machen bis zu 50% der diabetesassoziierten Todesfälle aus [1,2]. Hohe LDL-Cholesterinwerte zählen neben unzureichender glykämischer Kontrolle, Übergewicht und Bluthochdruck zu den Hauptrisikofaktoren [3]. Dass Cholesterinwerte ein relevanter Faktor sind und Diabetespatienten von einer Lipidsenkung profitieren können, geht aus Daten verschiedener prospektiver und randomisierter Studien hervor, erklärt Prof. Dr. med. Gottfried Rudofsky, Chefarzt Stoffwechselzentrum, Kantonsspital Olten [4].
Wie lauten die von der ESC empfohlenen Behandlungsziele?
Das Ziel einer lipidsenkenden Behandlung ist eine möglichst grosse Risikoreduktion kardiovaskulärer Ereignisse. Studien der vergangenen Jahre zeigen: je niedriger das LDL‑C, umso geringer ist das kardiovaskuläre Risiko. Demnach gibt es keine niedrigste LDL-C-Konzentrationsgrenze, unterhalb welcher das kardiovaskuläre Risiko nicht weiter abnimmt. Dies ist in die 2019 überarbeiteten ESC/EAS-Guidelines eingeflossen, wobei der Schwerpunkt der Expertenempfehlungen auf den Hochrisikopatienten liegt [5]. Die meisten Diabetiker gelten im Hinblick auf eine cholesterinsenkende Therapie als Hochrisikopatienten, bei welchen nach aktuellen Guidelines ein Zielbereich von <1,8 mmol/l angestrebt werden sollte (Tab. 1) [4,6,7]. Nur bei einer kleinen Gruppe von Diabetikern mit einem moderaten Risiko genügt ein LDL-Zielbereich <2,6 mmol/l. Liegt neben dem Diabetes noch eine manifeste arteriosklerotische Erkrankung vor, steigt das Risiko auf «sehr hoch» und es ist ein LDL-Zielbereich <1,4 mmol/l anzustreben. Falls es innerhalb von 2 Jahren unter maximal verträglicher Statintherapie zu einem zweiten vaskulären Ereignis kommt, ist das Risiko des Patienten massiv erhöht – in dieser Konstellation wird eine weitere LDL-Senkung auf <1,0 mmol/l empfohlen.
Zunächst aufdosierte Statintherapie, eventuell mit Ezetimib kombinieren
Wurde das Therapieziel festgelegt, sei der erste Behandlungsschritt die maximal verträglich Statin-Dosierung, so Prof. Rudofsky (Abb. 1). Bei der Aufdosierung sollte zum einen die «Rule of six» berücksichtigt werden, welche besagt, dass man mit der ersten Initialdosis die grösste Reduktion des LDL-C herbeiführen kann und jede weitere Verdopplung der Dosierung lediglich zu 6% zusätzlicher Cholesterinsenkung führt [8]. Zum anderen ist aber auch zu berücksichtigen, dass eine niedrigere Anfangsdosis mit geringeren Nebenwirkungsraten/Statinunverträglichkeit einhergeht. In einem zweiten Schritt kann die Ausdosierung erfolgen. Durch dieses gestufte Vorgehen wird vermieden, dass ein Patient fälschlicherweise als statinintolerant klassifiziert wird, was den weiteren Verlauf der Therapie verkompliziert. Eventuell ist der Einsatz eines der weniger potenten Statine, die aber oftmals verträglicher sind, zu prüfen.
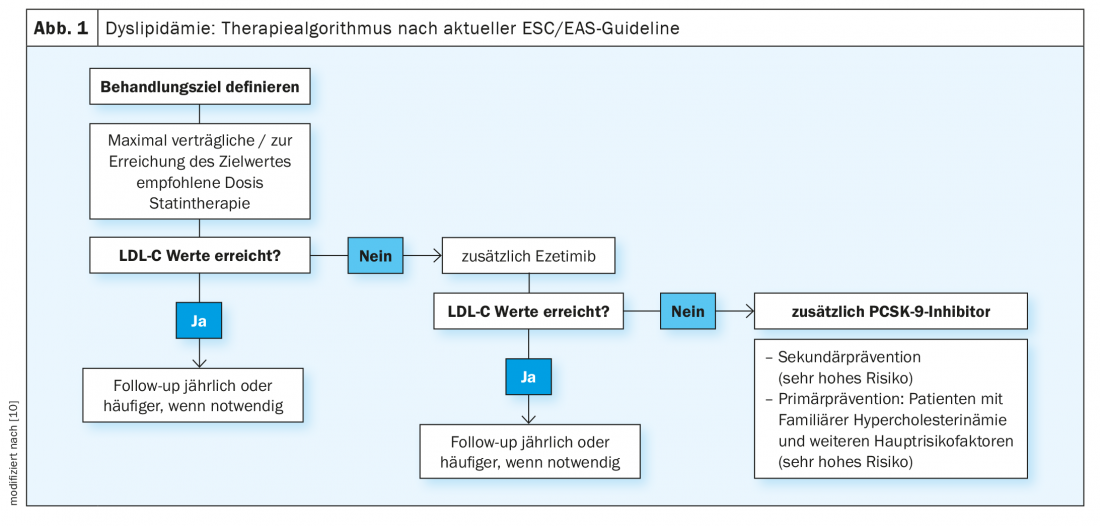
Wird das LDL-Ziel durch diese Behandlungsstrategie erreicht, empfiehlt Prof. Rudofsky regelmässige Nachkontrollen jeweils nach einem Jahr respektive je nach klinischer Situation [4]. Falls der Zielwertebereich nicht erreicht wird, kann durch die Kombination mit Ezetimib, das inzwischen auch in Fixkombinationen mit hochpotenten Statinen zur Verfügung steht, eine weitere LDL-Senkung erreicht werden. Ezetimib lagert sich am Bürstensaum des Dünndarms an, hemmt die Transporter für Cholesterol in der Membran der Mucosazellen und damit dessen Resorption. Ist der Transport von Cholesterol aus dem Darm in die Leber verringert, wird dort auch weniger gespeichert und die Cholesterol-Clearance aus dem Blut erhöht sich. Für Ezetimib liegt mit der Studie IMPROVE-IT eine kardiovaskuläre Endpunktstudie vor, die statistisch signifikante Unterschiede im primären Morbiditätsendpunkt im Vergleich zu einer Therapie mit Simvastatin allein zeigt [9]. Demnach hat Ezetimib für die Sekundärprophylaxe einen Zusatznutzen. 18’144 Patienten nach einem akuten Koronarsyndrom mit einem LDL-C-Wert von 50–125 mg/dl wurden randomisiert auf 40 mg Ezetimib/Simvastatin oder 40 mg Placebo/Simvastatin. Bei den 4933 Diabetikern, die an der Studie teilnahmen, wurde die grösste relative Reduktion bezüglich Myokardinfarkt (24%) und ischämischem Schlaganfall (39%) erzielt [12].
Werden Zielwerte nicht erreicht: PCSK-9-Hemmer einsetzen
Als letzte Eskalationsstufe stehen PCSK-9-Hemmer als «add-on» zur Verfügung, wodurch eine weitere Senkung des LDL-Wertes um 50–60% erzielt werden kann, was ein beträchtlicher Effekt ist (Abb. 1)[10]. Alirocumab und Evolocumab erhöhen durch Bindung an PCSK-9 die Anzahl der LDL-Rezeptoren in der Leber und senken LDL-C zusätzlich zu Statinen und Ezetimib bis zu Werten von 0,2 mmol/l. In der doppelblinden, multinationalen ODYSSEY-OUTCOMES-Studie konnte mit dem PCSK-9-Hemmer Praluent® (Alirocumab) bei kardiovaskulären Hochrisikopatienten innerhalb von 2,8 Jahren Tod, Herzinfarkt, Hirnschlag und instabile Angina um 15% und die Mortalität alleine ebenfalls um 15% gesenkt werden [11]. 18 924 Hochrisikopatienten, die in den vergangenen 12 Monaten vor der Randomisierung ein akutes Koronarsyndrom erlitten hatten, nahmen an der Studie teil. Es handelte sich um ein Patientenkollektiv, bei welchem trotz hochdosierter, maximal verträglicher Statintherapie mit zusätzlich kombinierten Lipidsenkern in der Run-in-Phase keine zufriedenstellende Lipidkontrolle. Prof. Rudofsky betont, dass der LDL-Wert bei Baseline bei rund 1,8 mmol/l lag, also bereits tief war und darauf nochmals eine Senkung erzielt werden konnte. Da Patienten mit Diabetes ein erhöhtes kardiovaskuläres Risiko haben im Vergleich zu Nicht-Diabetikern sei die absolute Risikoreduktion in dieser Subpopulation doppelt so hoch wie bei Patienten ohne Diabetes so Prof. Rudofsky und ergänzt: «Der Patient mit Typ-2-Diabetes profitiert da nochmals in besonderem Masse», wobei der Therapieeffekt bei denjenigen mit stärker ausgeprägten Gefässschädigungen am grössten zu sein scheint.
Quelle: Sanofi-Aventis
Literatur:
- Dal Canto E, et al.: European Journal of Preventive Cardiology 2019; 26(2), Suppl., 25–32.
- International Diabetes federation: IDF diabetes atlas 9th edition 2019. www.diabetesatlas.org, (letzter Abruf 18.10.2021)
- Wong K, et al.: J Diabetes Complications 2012; 26: 169–174.
- Der metabolische Patient: «Wissen tanken», Sanofi-Aventis AG, Webkonferenz, 26.08.2021
- Riesen WF, et al.: Swiss Med Forum 2020; 20(0910): 140–148.
- Rudofsky G, Hellige G, Arenja N: Der kardiovaskuläre Diabetespatient – eine interdisziplinäre Herausforderung. HAUSARZT PRAXIS 2021; 16(7): 10–16.
- Mach F, et al.: Eur Heart J 2020; 41: 111–188.
- Knopp RH: N Engl J Med 1999; 431: 498–511.
- Cannon CP, et al.: N Engl J Med 2015; 372: 2387–2397.
- Authors/Task Force Members; ESC Committee for Practice Guidelines (CPG); ESC National Cardiac Societies. 2019 ESC/EAS guidelines for the management of dyslipidaemias: Lipid modification to reduce cardiovascular risk. Atherosclerosis. 2019; 290: 140–205.
- Schwartz GG, et al.; N Engl J Med. 2018;379(22): 2097–2107.
- Giugliano RP, et al.: Circulation 2018; 137(15): 1571–1582.
HAUSARZT PRAXIS 2021; 16(10): 36–37
Autoren
- Mirjam Peter, M.Sc.
Publikation
- HAUSARZT PRAXIS





Comments are closed.