Zwischen neurovaskulären Erkrankungen und der Migräne bestehen verschiedene pathophysiologisch wie auch klinisch relevante Zusammenhänge. Aus diesem Blickwinkel betrachtet stellen sie zwei Seiten einer Medaille dar, und beide Seiten sollten in der Diagnostik und Therapie von Migränepatienten erkannt und berücksichtigt werden.
Zwischen neurovaskulären Erkrankungen und der Migräne bestehen verschiedene pathophysiologisch wie auch klinisch relevante Zusammenhänge. Aus diesem Blickwinkel betrachtet stellen sie zwei Seiten einer Medaille dar, und beide Seiten sollten in der Diagnostik und Therapie von Migränepatienten erkannt und berücksichtigt werden. Im Folgenden möchten wir eine Übersicht über die relevanten Wechselbeziehungen und deren klinische Implikationen geben.
Kopfschmerzen allgemein sowie speziell die Migräne zählen zu den häufigsten neurologischen Erkrankungen, mit einer Lebenszeitprävalenz von etwa 15% bei der Migräne [1]. Es besteht eine vielschichtige und teils komplexe Assoziation der Migräne mit neurovaskulären Erkrankungen [2,3]. Dies trifft insbesondere auch auf mikrovaskuläre Schädigungen im Sinne einer zerebralen Mikroangiopathie zu. Die Mikroangiopathie (englisch: «cerebral small vessel disease»/SVD) ist im Kontext neurovaskulärer Erkrankungen aus zahlreichen Gründen von klinischer Relevanz: sie ist eine häufige Ursache für ischämische Schlaganfälle wie auch – aufgrund ihrer Assoziation mit der arteriellen Hypertonie – für intrazerebrale Blutungen. Zudem stellt sie die häufigste Grundlage vaskulärer kognitiver Störungen bis hin zur Ausbildung einer vaskulären Demenz dar. Hinweise auf mikrovaskuläre Veränderungen finden sich auch bei der Migräne.
Mikrovaskuläre Veränderungen
Kenntnisse hierüber rühren nicht zuletzt von der monogen vererbten Schlaganfallerkrankung CADASIL (Cerebrale autosomal dominante Arteriopathie mit subkortikalen Infarkten und Leukencephalopathie). Diese geht nicht nur mit mikroangiopathischen Schlaganfällen einher, sondern bei mehr als einem Drittel der Patienten, insbesondere in jüngerem Alter, mit einer Migräne [4,5]; die Migräne, meist mit Aura, stellt oft das erste Symptom der Erkrankung dar, wobei atypische oder isoliert auftretende Aura-Symptome charakteristisch sind. Bildgebend finden sich bei der Erkrankung, welche die häufigste erbliche Schlaganfallform darstellt, typische mikroangiopathische, ischämische Marklagerläsionen («white matter hyperintensities»/WMH) [6].
Das Auftreten von ischämischen Marklagerläsionen findet sich jedoch nicht nur bei der Migräne im Kontext dieser erblichen Mikroangiopathie. Studien haben wiederholt gezeigt, dass auch bei der häufigen sporadischen Migräne teils Marklagerläsionen im Sinne von WMH zu finden sind, auch wenn überwiegend in deutlich geringerer Ausprägung [7–9].
Dieses wurde insbesondere in der sog. CAMERA-Studie demonstriert [7,8], in der sich ein Migräne-assoziiertes Auftreten von tiefen WMH bei betroffenen Migränepatientinnen fand. Als weitere Verbindung neurovaskulärer Schädigungen und der Migräne zeigten sich zudem bei der Migräne insbesondere im vertebrobasilären Versorgungsgebiet ischämisch anmutende T2-Läsionen, welche als sogenannte «infarct-like lesions» bezeichnet werden. Diese fanden sich – vor allem bei der Migräne mit Aura – mehr als fünf Mal häufiger als bei gesunden Kontrollen und waren interessanterweise mit einer erhöhten Attackenfrequenz assoziiert. Pathophysiologisch werden hierbei Migräne-assoziierte mikrovaskuläre bzw. hämodynamische Veränderungen diskutiert. Longitudinale Daten aus den Folgestudien der CAMERA-Studie, welche ca. 9 Jahre nach der ursprünglichen Studie erhoben wurden [9], ergaben Hinweise darauf, dass diese tiefen Marklagerläsionen bei der Migräne einer Progredienz unterliegen können, dieses mehr als bei den Kontrollprobanden ohne eine Migräne. Vor dem Hintergrund der oben erwähnten Beziehung der Mikroangiopathie zu vaskulären kognitiven Störungen stellt sich die Frage nach den klinischen Implikationen dieser – teils progredienten – Marklagerläsionen u.a. auf kognitive Funktionen: hierfür haben sich aber bisher keine klaren Assoziationen bei der sporadischen Migräne gezeigt, was möglicherweise auch im Kontext der Ausprägung und Läsionslast zu sehen ist, die bei der sporadischen Migräne wie erwähnt deutlich geringer ist als z.B. bei der erblichen Mikroangiopathie. In diesem Zusammenhang interessant: eine aktuelle Arbeit [10] fand, unabhängig von der Frage nach der Bedeutung der Marklagerläsionen, kein erhöhtes Demenz-Risiko bei Migräne-Patienten.
Ein anderer bildgebender Marker für eine Mikroangiopathie sind sogenannte zerebrale Mikroblutungen (engl.: «cerebral microbleeds»/CMB). Diese finden sich in verschiedener Ausprägung und Verteilung in den Häm-sensitiven MRI-Sequenzen (wie z.B. SWI-Sequenz: susceptibility weighted imaging) bei ca. 30 Prozent der Patienten mit einer zerebralen Mikroangiopathie. Interessanterweise gibt es auch für diesen Marker einer mikrovaskulären Schädigung Hinweise auf eine Assoziation mit der Migräne: so fanden sich vermehrt infratentorielle Mikroblutungen bei älteren Patienten mit einer Migräneanamnese, in diesem Fall eher bei der Migräne ohne Aura. Zudem fand sich das gleichzeitige Auftreten von Mikroblutungen und Schlaganfällen häufiger bei Patienten mit einer Migräne [11].
Pathophysiologie
Hinsichtlich der Pathophysiologie der mikrovaskulären Störungen bei der sporadischen Migräne gibt es verschiedene potenzielle Erklärungen: MR-spektroskopische Untersuchungen der Marklagerläsionen zum Beispiel weisen auf axonale, gliale Schädigungen wie auch Störungen des zellulären Energiestoffwechsels hin [12]. Insgesamt ist die Pathogenese nicht abschliessend geklärt und vermutlich komplex: es werden verschiedene pathophysiologische Grundlagen der vaskulär imponierenden Läsionen bei der Migräne diskutiert, dieses umfasst neben den mikrovaskulären Störungen (zerebrale Hypoperfusion, gestörte Vasoreaktivität, Schädigungen des Gefässendothels) auch thrombembolische Mechanismen und eine Störung der Blut-Hirn-Schranke. Letztendlich ergeben sich aus diesen verschiedenen Mechanismen möglicherweise in Zukunft auch Hinweise auf andere – nicht MRI-basierte – Krankheitsmarker bei der Migräne, wie z.B. Blut-basierte Biomarker, wie in einigen Studien bereits angedeutet [13,14]. Verlässliche Biomarker als Marker der Differenzialdiagnose, Erkrankungsaktivität oder auch prognostischen Einschätzung bzw. des Schlaganfallrisikos bei der Migräne wären wünschenswert, nicht zuletzt, da die Diagnosestellung der Migräne auch heute noch rein klinisch-anamnestisch auf dem Boden der diagnostischen Kriterien der Internationalen Kopfschmerzgesellschaft (IHS) basiert [15].
Erhöhtes Risiko für weitere vaskuläre Erkrankungen
Neben dem Zusammenhang zwischen Migräne und mikrovaskulären Störungen gibt es eine Vielzahl weiterer Verbindungen, z.B. in epidemiologischer, klinischer oder auch genetisch-pathophysiologischer Hinsicht. U.a. drei grosse Meta-Analysen haben den Zusammenhang zwischen Migräne und ischämischen Schlaganfall untersucht [16–18] und ein robust erhöhtes Schlaganfall-Risiko bei der Migräne aufzeigen können, insbesondere bei der Migräne mit Aura. Zudem zeigt eine Studie [19] einen Zusammenhang zwischen Migräne und weiteren vaskulären Phänotypen (Myokardinfarkt und periphere arterielle Verschlusskrankheit). Weiterhin können Attacken einer Migräne mit Aura unmittelbar in einen Schlaganfall münden, man spricht hier vom sog. migränösen Infarkt [15], einer aber eher seltenen und zudem kontrovers diskutierten Entität.
Klinisch bedeutsam ist, dass schwere Attacken einer Migräne mit Aura (z.B. mit motorischen oder anderen schweren Aura-Symptomen), v.a. bei der Erstmanifestation, das Vorliegen eines Schlaganfalls vortäuschen können (stroke mimic). Umgekehrt können zerebrale Ischämien das Vorliegen einer Migräne-Attacke einerseits vortäuschen (migraine mimic) und andererseits insbesondere – bei zu Grunde liegender Migräne-Suszeptibilität – das Auftreten symptomatischer Migräne-Attacken triggern [20]. Daher ist bei Patienten mit einer bekannten Migräne und für sie unbekannten Symptomen bzw. neuen fokal-neurologischen Defiziten besondere Vorsicht geboten. Abgesehen davon scheinen nach neueren Daten Kopfschmerzen ganz allgemein im Kontext einer akuten zerebralen Ischämie ein in seiner Häufigkeit eher unterschätztes Symptom zu sein [21].
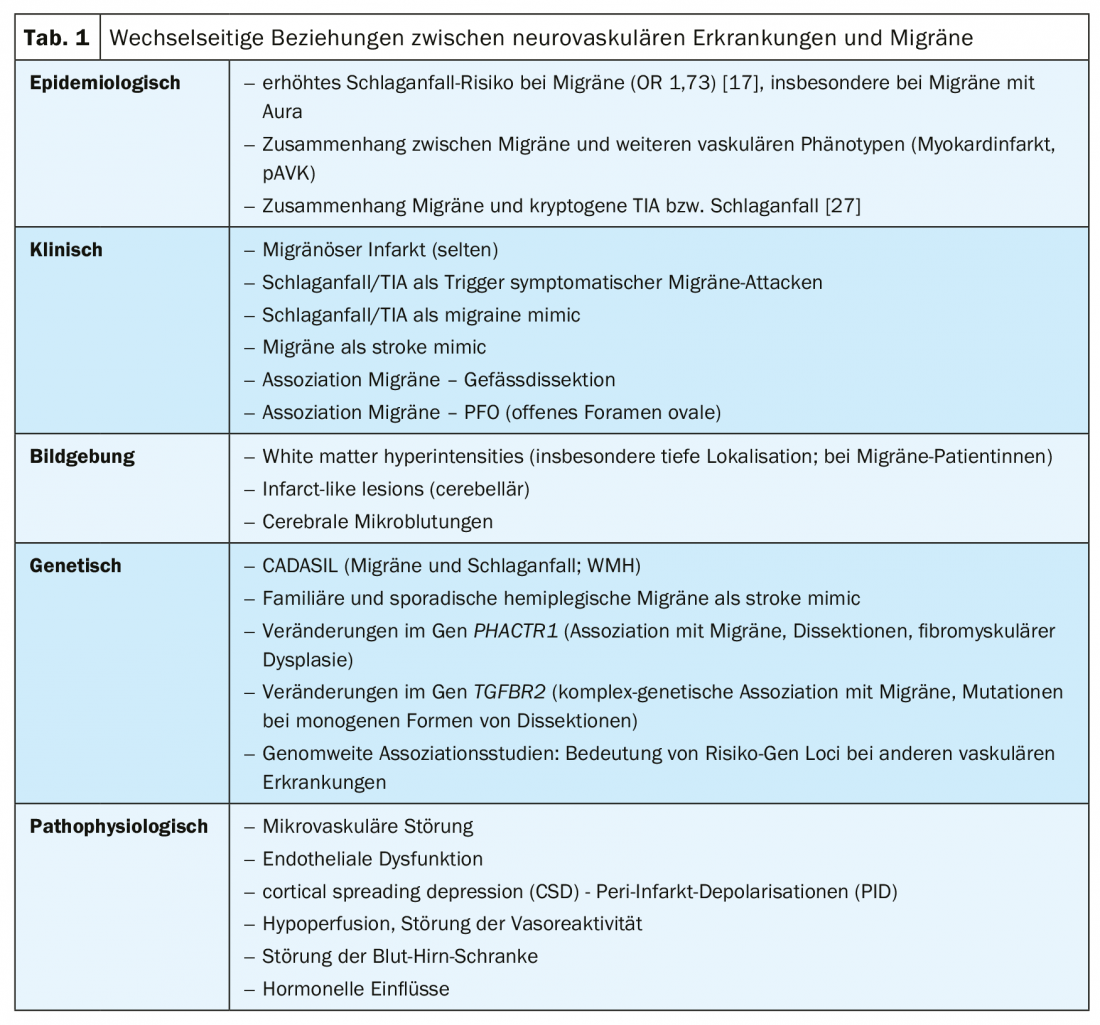
Schliesslich sei in diesem Kontext noch der Zusammenhang zwischen Migräne (v.a. ohne Aura) und Gefässdissektionen erwähnt [22,23]. Diesem kommt vor dem Hintergrund aktueller genetischer Untersuchungen – der Assoziation einer genetischen Veränderung im Gen PHACTR1 einerseits mit Migräne [24], andererseits aber eben auch mit Dissektionen [25] sowie anderen vaskulären Phänotypen (z.B. Myokardinfarkt oder fibromuskuläre Dysplasie) – zudem eine pathophysiologische Bedeutung zu. Hierbei gibt es Hinweise auf eine Störung im Bereich der Endothelfunktion [26]. Eine Aufstellung der komplexen Wechselbeziehung zwischen neurovaskulären Erkrankungen und Migräne auf den verschiedenen Ebenen findet sich in Tabelle 1.
Take-Home-Messages
- Es besteht eine vielschichtige Wechselbeziehung zwischen der Migräne und neurovaskulären, insbesondere mikrovaskulären Störungen, die für die klinische Betreuung von Migränepatienten eine Rolle spielt.
- Die Migräne (insbesondere mit Aura) ist ein typisches Frühsymptom bei der erblichen Mikroangiopathie CADASIL. Diese sollte differenzialdiagnostisch in Betracht gezogen werden, wenn atypische Aura-Symptome vorliegen, sich ausgeprägte Marklagerveränderungen (WMH) zeigen oder eine positive Familienanamnese für Migräne, Schlaganfälle bzw. Demenz besteht.
- Bei der sporadischen Migräne findet sich eine erhöhte Prävalenz von WMH, insbesondere bei Frauen. Diese zeigen sich teils über die Zeit progredient. Die Kenntnis hierüber ist u.a. für die differenzialdiagnostische Abgrenzung von entzündlichen Veränderungen z.B. im Rahmen einer MS bei jüngeren Patienten wichtig.
- Die klinische Relevanz der WMH bei der Migräne ist bis heute nicht abschliessend geklärt, Betroffene sollten nicht unnötig verunsichert werden.
- Neben WMH finden sich bei der Migräne (insbesondere mit Aura) gehäuft cerebellär lokalisierte a.e. ischämische Läsionen, was möglicherweise mit der Pathophysiologie und dem insbesondere okzipitalen Auftreten von Migräne-Auren (im Sinne visueller Auren) zusammenhängen kann.
- Die Migräne als klinisch i.d.R. episodische Erkrankung weist somit zudem «chronische» Merkmale auf.
- Die Migräne – insbesondere mit Aura – ist mit einem erhöhten Schlaganfallrisiko assoziiert.
- Echte migränöse Infarkte sind wahrscheinlich selten. Schlaganfälle können Migräne-Auren triggern.
- Es besteht ein epidemiologischer, genetischer und pathophysiologischer Zusammenhang zwischen Migräne und Dissektionen hirnversorgender Gefässe.
Literatur:
- Stovner Lj, Hagen K, Jensen R, et al.: The global burden of headache: a documentation of headache prevalence and disability worldwide. Cephalalgia. 2007; 27: 193–210.
- Freilinger C, Schubert V, Auffenberg E, Freilinger T: Migräne und vaskuläre Erkrankungen. Der Neurologe & Psychiater 2016; 17: 38–46.
- Malik R, Winsvold B, Auffenberg E, et al.: The migraine – vascular disease connection: a genetic perspective. Cephalalgia 2016; 36: 658–668
- Vahedi K, Chabriat H, Levy C, et al. Migraine with aura and brain magnetic resonance imaging abnormalities in patients with CADASIL. Arch Neurol 2004; 61: 1237–1240.
- Guey S, Mawet J, Hervé D, et al.: Prevalence and characteristics of migraine in CADASIL. Cephalalgia 2016; 36: 1038–1047
- Chabriat H, Joutel A, Dichgans M, et al.: CADASIL. Lancet Neurol 2009; 8: 643–653.
- Kruit MC, van Buchem MA, Hofman PA, et al.: Migraine as a risk factor for subclinical brain lesions. Jama 2004; 291: 427–434.
- Kruit MC, Launer LJ, Ferrari MD, et al.: Infarcts in the posterior circula- tion territory in migraine. The population-based MRI CAMERA study. Brain 2005; 128: 2068–2077.
- Palm-Meinders IH, Koppen H, Terwindt GM, et al.: Structural brain changes in migraine. JAMA. 2012; 308: 1889–1897.
- George KM, Folsom AR, Sharrett AR, et al.: Migraine Headache and Risk of Dementia in the Atherosclerosis Risk in Communities Neurocognitive Study. Headache 2020 May; 60 (5): 946-53
- Arkink EB, Terwindt GM, de Craen AJ, et al.: PROSPER Study Group. Infratentorial Microbleeds: Another Sign of Microangiopathy in Migraine. Stroke. 2015; 46: 1987–1989.
- Erdélyi-Bótor S1, Aradi M, Kamson DO, et al.: Changes of migraine-related white matter hyperintensities after 3 years: a longitudinal MRI study. Headache. 2015; 55: 55–70.
- Liman TG, Bachelier-Walenta K, Neeb L, et al.: (2015). Circulating endothelial microparticles in female migraineurs with aura. Cephalalgia : an international journal of headache, 35(2), 88–94.
- Pescini F, Donnini I, Cesari F, et al.: (2017). Circulating Biomarkers in Cerebral Autosomal Dominant Arteriopathy with Subcortical Infarcts and Leukoencephalopathy Patients. Journal of stroke and cerebrovascular diseases: the official journal of National Stroke Association, 26(4), 823–833.
- Headache Classification Committee of the International Headache Society (IHS) (2013). The International Classification of Headache Disorders, 3rd edition (beta version). Cephalalgia : an international journal of headache, 33(9), 629–808.
- Etminan M, Takkouche B, Isorna FC et al. Risk of ischaemic stroke in people with migraine: systematic review and meta-analysis of observational studies. Bmj 2005; 330: 63
- Schurks M, Rist PM, Bigal ME, et al.: Migraine and cardiovascular disease: systematic review and meta-analysis. Bmj 2009; 339: b3914.
- Spector JT, Kahn SR, Jones MR et al. Migraine headache and ischemic stroke risk: an updated meta-analysis. Am J Med 2010;123: 612–624.
- Bigal ME, Kurth T, Santanello N, et al.: Migrai- ne and cardiovascular disease: a population-based study. Neurology 2010; 74: 628– 635
- Olesen J, Friberg L, Olsen TS, et al.: (1993). Ischaemia-induced (symptomatic) migraine attacks may be more frequent than migraine-induced ischaemic insults. Brain: a journal of neurology, 116 (Pt 1), 187–202.
- Harriott KA (2020): Headache after ischemic stroke. Neurology 94 (1) e75–e86;
- Rist PM, Diener HC, Kurth T, et al.: Migraine, migraine aura, and cervical artery dissec- tion: a systematic review and meta-analysis. Cephalalgia 2011; 31(8): 886–896.
- Metso TM, Tatlisumak T, Debette S, et al.: Mi- graine in cervical artery dissection and ischemic stroke patients. Neurology 2012; 78(16): 1221–1228. Dissektionen
- Freilinger T, Anttila V, de Vries B, et al.: International Headache Genetics Consortium (2012). Genome-wide association analysis identifies susceptibility loci for migraine without aura. Nature genetics, 44(7), 777–782.
- Debette S, Kamatani Y, Metso TM, et al.: Common variation in PHACTR1 is associated with susceptibility to cervical artery dissection. Nat Genet. 2015;47(1):78–83. doi:10.1038/ng.3154
- Gupta RM, Hadaya J, Trehan A, et al.: (2017). A Genetic Variant Associated with Five Vascular Diseases Is a Distal Regulator of Endothelin-1 Gene Expression. Cell, 170(3), 522–533.e15.
- Li L, Schulz UG, Kuker W, et al.: Oxford Vascular Study (2015). Age-specific association of migraine with cryptogenic TIA and stroke: Population-based study. Neurology, 85(17), 1444–1451.
InFo NEUROLOGIE & PSYCHIATRIE 2020; 18(4): 6–9
Autoren
- Prof. Dr. med. Tobias Freilinger
- Prof. Dr. med. Nils Peters
Publikation
- INFO NEUROLOGIE & PSYCHIATRIE




Comments are closed.