Unter dem Reizdarmsyndrom (RDS) versteht man eine funktionelle Störung des unteren Verdauungssystems, wobei die Störung bei Frauen häufiger auftritt als bei Männern. Das RDS gehört zu den häufigsten gastrointestinalen Funktionsstörungen, es führt zu einer erheblichen Beeinträchtigung der Lebensqualität der Betroffenen und verursacht darüber hinaus grosse direkte sowie indirekte Kosten (insbesondere durch Arbeitsausfälle und verminderte Produktivität während der Arbeit). Der Übersichtsartikel stellt aktuelle Handlungsempfehlungen bezüglich Diagnostik und Therapie des RDS vor.
Unter dem Reizdarmsyndrom (RDS) versteht man eine funktionelle Störung des unteren Verdauungssystems [1] mit einer weltweit geschätzten Prävalenz von ca. 11% [2] sowie einer geschätzten Inzidenz von ca. 1,5% [3], wobei die Störung bei Frauen häufiger auftritt als bei Männern [4]. Mit einer Prävalenz von 5–10% in Deutschland [2] gehört das RDS zu den häufigsten gastrointestinalen Funktionsstörungen [5]. Das RDS führt hierbei zu einer erheblichen Beeinträchtigung der Lebensqualität der Betroffenen [6] und verursacht darüber hinaus grosse direkte (bspw. durch Arztbesuche, Medikamente, Diagnostik, Krankenhausaufenthalte etc.) sowie indirekte Kosten (insbesondere durch Arbeitsausfälle und verminderte Produktivität während der Arbeit) [7]. Der vorliegende Übersichtsartikel nimmt die 2021 in Deutschland veröffentliche, überarbeitete S3-Leitlinie für das RDS [7] zum Anlass, aktuelle Handlungsempfehlungen bezüglich Diagnostik und Therapie des RDS vorzustellen. Diese Leitlinie ist in Zusammenarbeit der entsprechenden Fachgesellschaften in Deutschland, aber auch unter Mitwirken der Schweizer Gesellschaft für Neurogastroenterologie und Motilität entstanden und hat auch in der Schweiz Gültigkeit.
Entsprechend der aktualisierten Leitlinie [7] liegt ein RDS dann vor, wenn folgende drei Kriterien erfüllt sind:
- chronische, das heisst länger als drei Monate anhaltende oder rezidivierende, auf den Darm bezogene Beschwerden (z.B. Bauchschmerzen, Blähungen), die in der Regel mit Stuhlgangveränderungen einhergehen;
- die Beschwerden führen dazu, dass die betroffene Person diesbezüglich Hilfe aufsucht und/oder sich sorgt und die Beschwerden hierbei so stark sind, dass die Lebensqualität relevant beeinträchtigt wird;
- keine für andere Krankheitsbilder charakteristischen Veränderungen liegen vor, die für die vorhandenen Symptome verantwortlich sind.
Prognostische Aussagen betreffend sind die Symptome eines RDS bei einem Teil der Patienten und Patientinnen spontan rückläufig, häufig aber auch chronisch verlaufend, wobei ein RDS nicht mit der Entwicklung anderer gastrointestinaler oder anderer schwerwiegender Erkrankungen assoziiert zu sein scheint und keine erhöhte Mortalität aufweist [8]. Eine hohe Komorbidität mit psychischen Erkrankungen konnte jedoch gezeigt werden [9]. Aufgrund fehlender Heilungsmöglichkeiten zielt die Behandlung eines RDS hauptsächlich auf die Linderung der Symptome ab [10]. Diesbezügliche therapeutische Massnahmen vor dem Hintergrund des biopsychosozialen Modells sind hierbei Gegenstand des vorliegenden Artikels.
Merke: Beim Reizdarmsyndrom handelt es sich um eine funktionelle Störung des unteren Verdauungssystems, die unter anderem mit andauernden, d.h. länger als drei Monate anhaltenden oder rezidivierenden, auf den Darm bezogenen Beschwerden wie Bauchschmerzen, Blähungen und Stuhlgangveränderungen einhergeht und die Lebensqualität der Betroffenen in bedeutsamem Ausmass beeinträchtigen.
Pathogenese
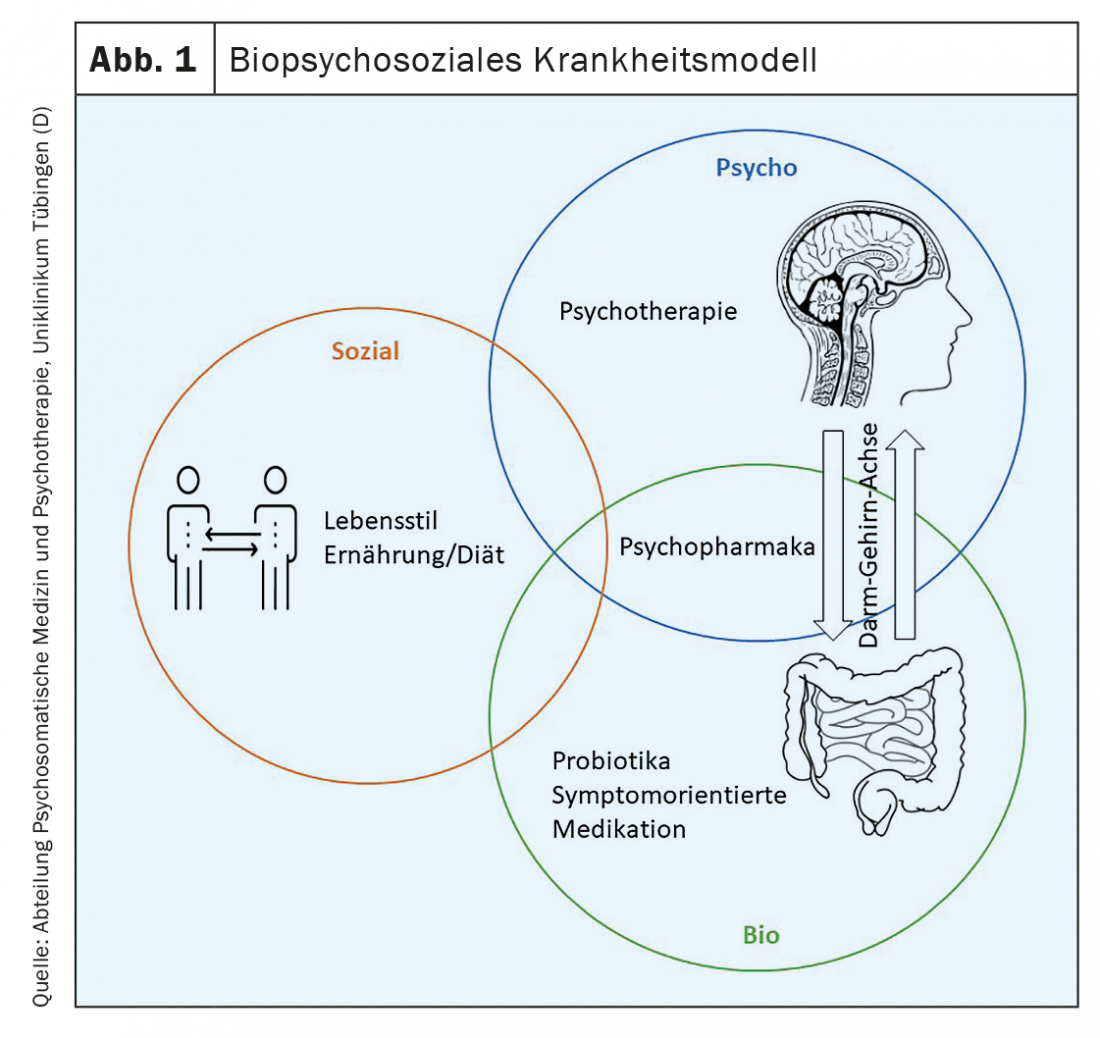
Basierend auf der Grundlage eines biopsychosozialen Modells ist davon auszugehen, dass verschiedene somatische (z.B. [Epi]-genetik, Infektionen), psychische (z.B. chronischer Stress, Krankheitsverhalten) sowie soziale Aspekte (z.B. sozioökonomischer Status) an der Pathophysiologie des RDS beteiligt sind [11]. So wurden zwischenzeitlich zahlreiche biologische Veränderungen identifiziert, die mit einer RDS-Symptomatik assoziiert sind [1,10]. Zu den häufigsten untersuchten Auffälligkeiten zählen beispielsweise Motilitätsstörungen, eine veränderte enterale Immunantwort sowie veränderte Schleimhautfunktionen, die sich in einer gestörten intestinalen Barriere und Sekretion äussern sowie eine viszerale Hypersensitivität. In Bezug auf die viszerale Hypersensitivität konnte auf neurologischer Ebene eine veränderte Signalverarbeitung in Hirnregionen festgestellt werden, die für die emotionale oder sensomotorische Verarbeitung viszeraler Signale verantwortlich sind [12]. Dieser Befund könnte eine plausible Erklärung für die Assoziation zwischen dem RDS und psychischen Faktoren bieten und unterstreicht darüber hinaus die Bedeutsamkeit der Darm-Gehirn-Achse bei der Pathophysiologie des RDS [13].
Im Sinne solch einer Darm-Gehirn-Achsen-Beteiligung scheint vor allem bei Patienten mit Diarrhö prädominantem RDS (RDS-D) eine reduzierte parasympathische Aktivierung nachweisbar zu sein, wobei diese reduzierte Aktivierung wiederum im Zusammenhang gebracht werden konnte mit dem Beschwerdeausmass, Missbrauchserfahrungen und Depressionssymptomen [14]. Eine Vielzahl von Studien belegt des Weiteren eine sympathische Überaktivierung bei Patienten mit RDS [15], was wiederum mit erhöhten Stresslevels assoziiert zu sein scheint [16]. Darüber hinaus zeigen Patienten mit RDS vor dem Hintergrund einer veränderten Darm-Gehirn-Achse stressinduzierte Veränderungen unter anderem der gastrointestinalen Motilität, des autonomen Tonus sowie der HPA-Achsen-Reaktion [17].
In jüngster Vergangenheit wurde zudem der Einfluss des Mikrobioms auf die Darm-Gehirn-Achse in Bezug auf Entstehung und Aufrechterhaltung des RDS näher untersucht [18]. Hierbei wurden Veränderungen sowohl in der Quantität als auch der Qualität der Gesamtheit der intestinalen Bakterien bei Patienten mit RDS festgestellt [18], wobei Stress und die intestinalen Bakterienflora wiederum miteinander interagieren und z.B. die viszerale Schmerzwahrnehmung von Patienten mit RDS beeinflussen können [19]. Die Veränderungen des Mikrobioms bei Pa-tien-ten mit RDS könnten darüber hinaus einen Erklärungsansatz für die Auswirkungen von Infektionen und Antibiotikatherapien bei der Entstehung des RDS liefern.
Bezüglich genetischer Prädispositionen zeigt sich beim RDS eine familiäre Häufung, teilweise über mehrere Generationen hinweg: So ist die Wahrscheinlichkeit, ein RDS zu entwickeln, bei einem Verwandten von einem am RDS Erkrankten etwa zwei- bis dreifach erhöht [20]. Erste Studienergebnisse legen darüber hinaus nahe, dass auch epigenetische Faktoren in die Genese von RDS involviert sein könnten [21].
Eine hohe Komorbidität mit affektiven Störungen, insbesondere von Angst- und depressiven Störungen, ist beim RDS sehr gut belegt [22]. Eine chronische Stressbelastung sowie psychische Komorbiditäten werden hierbei als Risikofaktoren für die Entstehung und Aufrechterhaltung des RDS betrachtet [23]. So haben sich erhöhte Angst- und depressive Symptome [24] sowie eine reduzierte Lebensqualität [25] als Prädiktoren für die Erstmanifestation des RDS erwiesen. Des Weiteren ist die Prävalenz von belastenden Lebensereignissen in der Vorgeschichte (bspw. Missbrauchs-erfahrungen bzw. Kindheitstraumata) im Vergleich zu gesunden Vergleichspersonen erhöht [26]. Zudem konnte gezeigt werden, dass psychometrisch erfasste Angst- und depressive Symptomatik positiv mit dem Schmerzausmass korreliert [27] und sich negativ auf das Völlegefühl- und das Blähungsgefühl auswirken kann [28]. Angst- und depressive Störungen können sich aber auch sekundär als Folge der Belastung durch die chronischen gastrointestinalen Beschwerden entwickeln [24]. Darüber hinaus scheinen Aspekte der Krankheitsbewältigung bzw. Bewältigungsstrategien im Umgang mit Belastungen und Symptomen (insbesondere Katastrophisieren) sowie unter anderem durch das soziale Umfeld erlerntes Krankheitsverhalten (bspw. Interpretation von Körperwahrnehmungen als «problematische Symptome», maladaptives Vermeidungsverhalten etc.) eine wichtige Rolle bei der Entstehung und der Aufrechterhaltung des RDS zu spielen [29–31]. Auch der Einfluss von Persönlichkeitseigenschaften wird in einigen Studien berücksichtigt: so scheint vor allem die Persönlichkeitsskala Neurotizismus eine Rolle zu spielen und sollte im Sinne der Vulnerabilität, ein RDS zu entwickeln, weiter untersucht werden [31].
Zusammenfassend scheinen bei der Pathogenese des RDS vor dem Hintergrund eines biopsychosozialen Modells komplexe Wechselwirkungsprozesse zwischen Stressbelastung, psychischer Komorbidität und gastrointestinaler Symptomatik im Sinne eines Teufelskreises naheliegend [32].
Merke: Das biopsychosoziale Modell berücksichtigt verschiedene somatische und psychosozialen Faktoren innerhalb der Pathophysiologie des RDS und integriert deren vielseitigen Wechselwirkungsprozesse. So wurden zwischenzeitlich zahlreiche biologische Veränderungen identifiziert, die mit einer RDS-Symptomatik assoziiert sind. Eine plausible Erklärung für die Assoziation zwischen dem RDS und psychischen Faktoren bietet vor allem die Darm-Gehirn-Achse. Komplexe Wechselwirkungsprozesse zwischen Stressbelastung, psychischer Komorbidität und gastrointestinaler Symptomatik im Sinne eines Teufelskreises scheinen hierbei naheliegend.
Therapie
Korrespondierend zu einem sehr heterogenen Krankheitsbild in Bezug auf Pathogenese, Manifestation der Symptome und die resultierenden Beeinträchtigungen im Alltag, existiert auch ein sehr breites Spektrum an potenziell wirksamen Behandlungsprinzipien vor dem Hintergrund des biopsychosozialen Krankheitsmodells (Abb. 1). Infolge dieser Heterogenität ist nicht «die» Standardtherapie des RDS zu benennen, vielmehr weist jede therapeutische Intervention zunächst probatorischen Charakter auf. Hierbei sollten entsprechend der S3-Leitlinie bei nur partiellem Ansprechen auf eine Monotherapie und/oder zur Behandlung verschiedenartiger symptomatischer Beschwerden sowohl Kombinationen verschiedener medikamentöser Substanzen als auch Kombina-tio-nen medikamentöser und nicht-medikamentöser Behandlungen erwogen werden [7]. Diese Behandlungsbausteine werden im Folgenden näher erörtert.
Lebensstil: Die aktuelle Datenlage bezüglich evidenzbasierter Empfehlungen zu günstigen Veränderungen des Lebensstils (bspw. nicht rauchen, wenig Alkohol, bewusst essen, ausreichend Bewegung, genug schlafen, Stressabbau u.a.) ist aktuell spärlich und (trotz teilweise positiver Beobachtungen) noch widersprüchlich [33]. Es gibt dennoch wenige qualitativ hochwertige Studien, die zeigen, dass vor allem körperliche Bewegung über einen Zeitraum von zwölf Wochen einen (eventuell auch langfristig) positiven Effekt auf die RDS-Symptomatik haben kann [34,35].
Merke: Entsprechend der aktualisierten S3-Leitlinie sollten bei nur partiellem Ansprechen auf eine Monotherapie und/oder zur Behandlung verschiedenartiger Beschwerden besonders integrative und multimodale Behandlungskonzepte bei der Therapie des RDS Anwendung finden.
Ernährung/Diäten: Entsprechend der S3-Leitlinie sind ernährungsmedizinische/ernährungstherapeutische Massnahmen sinnvoller Bestandteil eines Therapiekonzepts für Patienten mit einem RDS [7]. So konnten bei Patienten mit RDS mit überwiegend obstipativen Beschwerden (RDS-O) Symptombesserungen infolge einer vermehrten Einnahme von Ballaststoffe (bevorzugt löslicher Natur) erzielt werden [36]. Bei Schmerzen, Blähungen und Diarrhö als dominante Symptome sollte eine sogenannte Low-FODMAP-Diät empfohlen werden. Hierbei sollten unter begleitender medizinischer Ernährungsberatung zunächst fermentierbare Oligo-, Di- und Monosaccharide und Polyole (FODMAPs) in der Nahrungsaufnahme vermieden werden (Eliminationsphase). FODMAPs sind kurzkettige Kohlenhydrate, die im Dünndarm schlecht absorbiert werden. Spätestens im Dickdarm werden sie dann osmotisch aktiv und rasch fermentiert, so dass Bauchschmerzen, Blähungen und ein weicher, voluminöser Stuhlgang folgen können. Sobald sich die Symptome infolge der Eliminationsphase verbessern, können schrittweise Nahrungsmittel mit höherem FODMAP-Gehalt wieder eingeführt werden [37]. Entsprechend diesem Schema ist es möglich herauszufinden, welche Nahrungsmittel Symptome auslösen bzw. verschlechtern und welche toleriert werden (Phase der Toleranzfindung). Alle Lebensmittel, die symptomfrei gegessen werden konnten, werden anschliessend in den Langzeit-Ernährungsplan mitaufgenommen (Phase der Lang-zeit-Ernährung). Eine Reihe von Studien konnte hierbei eine Verbesserung der RDS-Beschwerden unter einer Restriktion von FODMAPs nachweisen [38].
Merke: Körperliche Bewegung kann sich positiv auf die RDS-Symptomatik auswirken.
Symptomorientierte Medikation: Eine Pharmakotherapie des RDS sollte stets symptomorientiert und unter Berücksichtigung der dominierenden Beschwerden erfolgen [7]. Zur Behandlung des RDS-D wird laut Leitlinie die Medikation mit dem Peristaltik-Hemmer Loperamid (µ-Opioid-Rezeptor Agonist) empfohlen. Trotz guter Wirksamkeits-Evidenz sollte der ebenfalls Opioid-basierte Wirkstoff Eluxadolin laut aktualisierter Leitlinie nur in ausgewählten Einzelfällen bei anderweitig therapierefraktärem RDS-D erwogen werden, da die Anwendung unter anderem mit akuten Pankreatitiden assoziiert zu sein scheint, sowie insbesondere bei Patienten nach Cholezystektomie, mit Gallengangserkrankungen, Alkoholismus, Leberzirrhose und Sphinkter-Oddi Dysfunktion nicht angewendet werden sollte. Zur Behandlung von chologenen Diarrhöen sollte der Cholesterin-Resorptionshemmer Colestyramin eingesetzt werden. Colesevelam kann vor selbigem pathophysiologischem Hintergrund ebenfalls eingesetzt werden. Des Weiteren sollte bei anderweitig therapierefraktärem RDS-D eine Off-Label-Therapie mit 5-HT3-Antagonisten (z.B. Ondan-setron) versucht werden [7].
Merke: Vor allem die sogenannte «low-FODMAP-Diät» kann nachweislich RDS-Beschwerden lindern.
Zur Behandlung von Obstipationsbeschwerden sollen Laxantien vom Macrogoltyp empfohlen werden. Bleibt ein Ansprechen auf konventionelle Laxantien aus oder werden diese nicht vertragen, sollte zur Behandlung der 5-HT4-Agonist Prucaloprid versucht werden. Des Weiteren sollte der Peptidarzneistoff Linaclotid (Guanylatzyklase-C-Agonist) bei Laxanzien-refraktärer Obstipation und insbesondere bei begleitenden Bauchschmerzen und Blähungen empfohlen werden, die Behandlung wird in Deutschland jedoch nicht erstattet. Bei fehlender Zulassung sowie eingeschränkter Verfügbarkeit in Deutschland sollte Lubiproston aus der Gruppe der Chloridkanal-Aktivatoren nur in ausgewählten Einzelfällen bei anderweitig Therapie-refraktärem RDS-O erwogen werden [7].
Zur Behandlung der RDS-assoziierten Schmerzen sollen entsprechend der S3-Leitlinie Spasmolytika wie beispielsweise Butylscopolamin empfohlen werden [7]. Darüber hinaus hat sich Pfefferminzöl aus der Gruppe der Phytotherapeutika als wirksam zur Behandlung der RDS-Symptome Schmerz und Blähungen erwiesen und soll dementsprechend erwogen werden. Weitere phytotherapeutische Präparate wie die Pflanzenmixtur STW-5 (Iberis Amara, Angelikawurzel, Kamillenblüten, Kümmelfrüchte, Mariendistelfrüchte, Melissenblätter, Pfefferminzblätter, Schöllkraut und Süssholzwurzel) und STW-5-II (Iberis Amara, Kamillenblüten, Kümmelfrüchte, Melissenblätter, Pfefferminzblätter und Süssholzwurzel) konnten eine Symptomlinderung insbesondere von abdominellen Schmerzen erzielen und sollten individuell ins Behandlungskonzept integriert werden.
Des Weiteren sollte das in Deutschland für diese Indikation nicht zugelassene Antibiotikum Rifaximin zur Behandlung von Blähbeschwerden bei anderweitig therapierefraktären RDS ohne Obstipation erwogen werden. Die Frage nach einer möglichen Resistenzentwicklung bei rezidivierender und/oder längerfristiger Anwendung ist zum aktuellen Zeitpunkt jedoch noch ungeklärt [7].
Merke: Die medikamentöse Therapie des RDS sollte stets symptomorientiert und unter Berücksichtigung der dominierenden Beschwerden erfolgen. So kommen bei RDS-D vor allem Peristaltik-Hemmer und bei der Behandlung von Obstipationsbeschwerden vordergründig Laxantien vom Macrogoltyp zum Einsatz. Bei der Behandlung der RDS assoziierten Schmerzen finden vor allem Spasmolytika wie beispielsweise Butylscopolamin Anwendung.
Probiotika: Bezüglich der generellen Wirksamkeit von Probiotika zur Behandlung von RDS-assoziierten Beschwerden kann aufgrund einer grossen methodologischen und qualitativen Heterogenität der Studienlage zum gegenwärtigen Zeitpunkt noch keine gesicherte Aussage getroffen werden. Es konnten jedoch für einzelne in Deutschland gebräuchliche probiotische Stämme (bspw. Bifidobacterien, Lactobacillus) sowie Multispezies-Produkte im Rahmen von randomisierten, kontrollierten klinischen Studien signifikante Verbesserungen sowohl für RDS-typische Symptome wie Schmerzen, Blähungen sowie Veränderungen der Stuhlfrequenz und -konsistenz als auch für die Lebensqualität und die allgemeine Zufriedenheit der Studienteilnehmenden erzielt werden. Entsprechend der Leitlinie sollte infolgedessen jeder Behandlungsversuch mit Probiotika zunächst unter probatorischem Charakter durchgeführt und nur nach überzeugender Beschwerdelinderung fortgeführt werden [7].
Merke: Einzelne probiotische Stämme sowie Multispezies-Produkte erwiesen sich bereits nachweislich als wirksam, eine generelle Wirksamkeit von Probiotika konnte bisher jedoch noch nicht belegt werden, sodass jeder Behandlungsversuch mit Probiotika zunächst probatorischen Charakter aufweist.
Psychopharmaka: Das trizyklische Antidepressivum Amitriptylin sollte laut Leitlinie bei Erwachsenen unter anderem zur Therapie von Schmerzen eingesetzt werden (mit Ausnahme von Obstipation), sollte jedoch bei älteren Patienten aufgrund der anticholinergen Nebenwirkung möglichst nicht zur Anwendung kommen [7]. Da trizyklische Antidepressiva die orozökale wie auch die gesamte gastrointestinale Transitzeit verlängern, erscheint es darüber hinaus zweckmässig, Trizyklika bei RDS-D anzuwenden [39]. Im Gegensatz dazu verkürzen Antidepressiva vom SSRI-Typ die orozökale Transitzeit, sodass es sinnvoll erscheint, diese bei RDS-O einzusetzen. Da die Studienlage zum Einsatz von SSRI bei RDS bisher jedoch inkonsistente Ergebnisse lieferte und darüber hinaus in Deutschland keine Zulassung für den Einsatz von SSRI für das RDS besteht, können entsprechend der aktualisierten Leitlinie Antidepressiva vom SSRI-Typ nur bei psychischer Komorbidität erwogen werden. Darüber hinaus kann der Einsatz des Serotonin-Noradrenalin-Wiederaufnahmehemmers (SNRI) Duloxetin bei Erwachsenen mit komorbider Angst- und depressiver Störung erwogen werden [40].
Merke: Vor allem das trizyklische Antidepressivum Amitriptylin findet bei Erwachsenen unter anderem zur Therapie von RDS assoziierten Schmerzen Anwendung. Antidepressiva vom SSRI-Typ können laut aktualisierter Leitlinie lediglich bei psychischer Komorbidität erwogen werden.
Psychotherapie: Entsprechend der S3-Leitlinie sind psychoedukative Elemente, wie die Vermittlung von Informationen über das RDS und den Zusammenhang von belastenden Emotionen und dem Auftreten von Beschwerden, als kosteneffizientes Angebot im Rahmen der sonstigen Behandlung sinnvoll [7], da sie nachweislich positive Effekte auf die Beschwerden sowie die Lebensqualität von Patienten mit RDS zeigen [9]. Darüber hinaus sollten Strategien zum Umgang mit Stress und/oder Krankheitsbewältigung (Coping) individuell als adjuvante Massnahmen im Sinne von geführten Selbsthilfemassnahmen empfohlen werden [41]. Hierbei konnte in mehreren Studien eine Reduktion der RDS-Symptome sowie eine Steigerung der Lebensqualität der Betroffenen erzielt werden, wobei erste Ergebnisse darauf hindeuten, dass insbesondere online-basierte Angebote (eHealth-Interventionen) eine hilfreiche Ergänzung darstellen können [42].
Als weitergehendes Angebot sollen darüber hinaus fachpsychotherapeutische Verfahren bei passender Indikation als Teil des Behandlungskonzeptes angeboten werden. Hinsichtlich der grundsätzlichen Indikationsstellung zur Psychotherapie, unabhängig vom jeweiligen Verfahren, sind der Patientenwunsch, eine durch die gastrointestinale Symptomatik signifikant beeinträchtige Lebensqualität sowie etwaige psychische Komorbiditäten ausschlaggebend [41]. In diesem Zusammenhang gibt es deutliche Hinweise auf die Effektivität von Psychotherapien beim RDS, wobei mit Abstand am meisten Studien zur kognitiven Verhaltenstherapie veröffentlich wurden. Diese erwies sich als wirksam und Kontrollbedingungen überlegen [43]. Zu psychodynamischen Verfahren existieren zwar weniger Studien, aber auch diese erwiesen sich als nachweislich wirksam [43]. Auch achtsamkeitsbasierte Therapieformen zeigten in einzelnen Studien kleine bis moderate positive Effekte, aufgrund der derzeitig noch reduzierten Studienlage wird in den Leitlinien jedoch noch keine abschliessende Empfehlung für die selbigen ausgesprochen [7].
Als einziges Organ-spezifisches psychotherapeutisches Verfahren im Rahmen der Behandlung des RDS gilt die Bauch-gerichtete Hypnose (gut-directed hypnosis, GDH), für die in mehreren Metaanalysen positive Effekte auf die Symptombesserung mit mittlere Effektstärken berichtet wurden [44,45]. Schwere psychische Erkrankungen (z.B. schwere Depressionen und Panikstörungen) gelten hierbei jedoch als relative Kontraindikation.
Entspannungstherapie (z.B. Progressive Muskel-entspannung nach Jacobson, Autogenes Training) sollte entsprechend der Leitlinie nicht als Monotherapie, sondern im Rahmen eines multimodalen Behandlungskonzepts angeboten werden [7], selbiges gilt für Achtsamkeitsbasiertes Yoga. Bei Indikation zur Psychotherapie kann diese gegebenenfalls mit einer Psychopharmakotherapie kombiniert werden [41].
Merke: Psychoedukative Elemente sind als kosteneffizientes Angebot im Rahmen der sonstigen Behandlung nachweislich sinnvoll. Aufgrund mehrfach nachgewiesener Effektivität von Psychotherapie beim RDS sollen fachpsychotherapeutische Verfahren bei passender Indikation (bspw. bei psychischer Komorbidität) als Teil des Behandlungskonzeptes angeboten werden. Als organspezifisches psychotherapeutisches Verfahren im Rahmen der Behandlung des RDS findet die Bauch-gerichtete Hypnose Einsatz.
Fazit
Das biopsychosoziale Modell berücksichtigt verschiedene somatische und psychosozialen Faktoren innerhalb der Pathophysiologie des RDS und integriert deren vielseitige Wechselwirkungsprozesse. Darüber hinaus können therapeutische Ansatzpunkte auf biologischer, psychologischer und sozialer Ebene identifiziert und umgesetzt werden. Vor diesem Hintergrund scheinen besonders integrative und multimodale Behandlungskonzepte bei der Therapie des RDS vielversprechend und sollten in der klinischen Forschung weiter auf ihre Wirksamkeit untersucht werden.
Take-Home-Messages
- Beim Reizdarmsyndrom handelt es sich um eine funktionelle Störung des unteren Verdauungssystems, die unter anderem mit andauernden, auf den Darm bezogenen Beschwerden wie Bauchschmerzen, Blähungen und Stuhlgangveränderungen einhergeht und zu erheblichem Leid der Betroffenen führt.
- Basierend auf der Grundlage eines biopsychosozialen Modells ist davon auszugehen, dass verschiedene somatische, psychische und soziale Aspekte an der Pathophysiologie des RDS beteiligt sind. Komplexe Wechselwirkungsprozesse zwischen Stressbelastung, psychischer Komorbidität und gastrointestinaler Symptomatik im Sinne eines Teufelskreises sind hierbei naheliegend.
- Dementsprechend vielfältig ist das Spektrum an therapeutischen Interventionen, um den Symptomen des RDS beizukommen sowie die Lebensqualität der Betroffenen zu steigern. Therapeutische Ansatzpunkte können hierbei auf biologischer, psychologischer und sozialer Ebene identifiziert und umgesetzt werden.
- Vor diesem Hintergrund scheinen besonders integrative und multimodale Behandlungskonzepte bei der Therapie des RDS vielversprechend und sollten in der klinischen Forschung weiter auf ihre Wirksamkeit untersucht werden.
Literatur:
- Mearin F, Lacy BE, Chang L, et al.: Bowel disorders. Gastroenterology 2016 Feb 18; S0016-5085(16)00222-5.
- Lovell RM, Ford AC.: Global prevalence of and risk factors for irritable bowel syndrome: a meta-analysis. Clinical Gastroenterology and Hepatology 2012; 10(7): 712–721.e4.
- Halder SLS, Locke GR, Schleck CD et al.: Natural history of functional fastrointestinal disorders: A 12-year longitudinal population-based study. Gastroenterology 2007; 133(3): 799–807.e1.
- Andrews EB, Eaton SC, Hollis KA, et al.: Prevalence and demographics of irritable bowel syndrome: results from a large web-based survey. Alimentary Pharmacology & Therapeutics 2005; 22(10): 935–942.
- Lacy BE, Patel NK: Rome criteria and a diagnostic approach to irritable bowel syndrome. Journal of Clinical Medicine 2017; 6(11): 99.
- Gralnek IM, Hays RD, Kilbourne A, et al.: The impact of irritable bowel syndrome on health-related quality of life. Gastroenterology 2000; 119(3): 654–660.
- Layer P, Andresen V, Allescher H, et al.: Update S3-Leitlinie Reizdarmsyndrom: Definition, Pathophysiologie, Diagnostik und Therapie des Reizdarmsyndroms der Deutschen Gesellschaft für Gastroenterologie, Verdauungs- und Stoffwechselkrankheiten (DGVS) und der Deutschen Gesellschaft für Neurogastroenterologie und Motilität (DGNM). AWMF 2021.
- Spiller R, Aziz Q, Creed F, et al.: Guidelines on the irritable bowel syndrome: mechanisms and practical management. Gut 2007; 56(12): 1770–1798.
- Weibert E, Stengel A: The role of psychotherapy in the treatment of irritable bowel syndrome. Psychother Psychosom Med Psychol 2019; 69(9–10): 360–371.
- Enck P, Aziz Q, Barbara G, et al.: Irritable bowel syndrome. Nat Rev Dis Primers 2016; 2: 16014.
- Drossman DA: Functional gastrointestinal disorders: history, pathophysiology, clinical features, and Rome IV. Gastroenterology 2016; 150(6): 1262–1279.e2.
- Mayer EA, Gupta A, Kilpatrick LA, Hong JY: Imaging brain mechanisms in chronic visceral pain. Pain 2015; 156: S50–63.
- Raskov H, Burcharth J, Pommergaard HC, Rosenberg J: Irritable bowel syndrome, the microbiota and the gut-brain axis. Gut Microbes 2016; 7(5): 365–383.
- Mazurak N, Seredyuk N, Sauer H et al.: Heart rate variability in the irritable bowel syndrome: a review of the literature. Neurogastroenterology & Motility 2012; 24(3): 206–216.
- Liu Q, Wang EM, Yan XJ, Chen SL.: Autonomic functioning in irritable bowel syndrome measured by heart rate variability: A meta-analysis. Journal of Digestive Diseases 2013; 14(12): 638–646.
- Heitkemper M, Jarrett M, Cain K, et al.: Increased urine catecholamines and cortisol in women with irritable bowel syndrome. Am J Gastroenterol 1996; 91(5): 906–913.
- Chang L: The role of stress on physiological responses and clinical symptoms in irritable bowel syndrome. Gastroenterology 2011; 140(3): 761–765.
- Kennedy PJ, Cryan JF, Dinan TG, Clarke G: Irritable bowel syndrome: a microbiome-gut-brain axis disorder? World J Gastroenterol 2014; 20(39): 14105–14125.
- Moloney RD, Johnson AC, O’Mahony SM, et al.: Stress and the microbiota-gut-brain axis in visceral pain: relevance to irritable bowel syndrome. CNS Neurosci Ther 2016; 22(2): 102–117.
- Saito YA: The role of genetics in IBS. Gastroenterol Clin North Am 2011; 40(1): 45–67.
- Dinan TG, Cryan J, Shanahan F et al.: IBS: An epigenetic perspective. Nat Rev Gastroenterol Hepatol 2010; 7(8): 465–471.
- Whitehead WE, Palsson O, Jones KR: Systematic review of the comorbidity of irritable bowel syndrome with other disorders: what are the causes and implications? Gastroenterology 2002; 122(4): 1140–1156.
- Tanaka Y, Kanazawa M, Fukudo S, Drossman DA: Biopsychosocial model of irritable bowel syndrome. J Neurogastroenterol Motil 2011; 17(2): 131–139.
- Koloski NA, Jones M, Kalantar J, et al.: The brain–gut pathway in functional gastrointestinal disorders is bidirectional: a 12-year prospective population-based study. Gut 2012; 61(9): 1284–1290.
- Ford AC, Forman D, Bailey AG, et al.: Irritable bowel syndrome: a 10-yr natural history of symptoms and factors that influence consultation behavior. Am J Gastroenterol 2008; 103(5): 1229–1239; quiz 1240.
- Chitkara DK, van Tilburg MAL, Blois-Martin N, Whitehead WE: Early life risk factors that contribute to irritable bowel syndrome in adults: a systematic review. Am J Gastroenterol 2008; 103(3): 765–774; quiz 775.
- Elsenbruch S, Rosenberger C, Enck P et al.: Affective disturbances modulate the neural processing of visceral pain stimuli in irritable bowel syndrome: an fMRI study. Gut 2010; 59(4): 489–495.
- Van Oudenhove L, Törnblom H, Störsrud S, et al.: Depression and somatization are associated with increased postprandial symptoms in patients with irritable bowel syndrome. Gastroenterology 2016; 150(4): 866–874.
- Drossman DA, Leserman J, Li Z et al.: Effects of coping on health outcome among women with gastrointestinal disorders. Psychosom Med 2000; 62(3): 309–317.
- Van Oudenhove L, Crowell MD, Drossman DA, et al.: Biopsychosocial aspects of functional gastrointestinal disorders. Gastroenterology 2016; S0016-5085(16)00218-3.
- Lackner JM, Gudleski GD, Thakur ER, et al.: The impact of physical complaints, social environment, and psychological functioning on IBS patients’ health perceptions: looking beyond GI symptom severity. Am J Gastroenterol 2014; 109(2): 224–233.
- Blanchard EB, Lackner JM, Jaccard J et al.: The role of stress in symptom exacerbation among IBS patients. J Psychosom Res 2008; 64(2): 119–128.
- Kang SH, Choi SW, Lee SJ, et al.: The effects of lifestyle modification on symptoms and quality of life in patients with irritable bowel syndrome: a prospective observational study. Gut Liver 2011; 5(4): 472–477.
- Johannesson E, Simrén M, Strid H, et al.: Physical activity improves symptoms in irritable bowel syndrome: a randomized controlled trial. Am J Gastroenterol 2011; 106(5): 915–922.
- Johannesson E, Ringström G, Abrahamsson H, Sadik R: Intervention to increase physical activity in irritable bowel syndrome shows long-term positive effects. World J Gastroenterol 2015; 21(2): 600–608.
- Zuckerman MJ: The role of fiber in the treatment of irritable bowel syndrome: therapeutic recommendations. J Clin Gastroenterol 2006; 40(2): 104–108.
- Hetterich L, Stengel A: Ernährungsmedizinische Aspekte beim Reizdarmsyndrom – ein Update. Aktuelle Ernährungsmedizin 2020; 45(4): 276–285.
- Rao SSC, Yu S, Fedewa A: Systematic review: dietary fibre and FODMAP-restricted diet in the management of constipation and irritable bowel syndrome. Aliment Pharmacol Ther 2015; 41(12): 1256–1270.
- Hetterich L, Zipfel S, Stengel A: Gastrointestinal somatoform disorders. Fortschr Neurol Psychiatr 2019; 87(9): 512–525.
- Ford AC, Lacy BE, Harris LA, et al.: Effect of antidepressants and psychological therapies in irritable bowel syndrome: an updated systematic review and meta-analysis. Official journal of the American College of Gastroenterology | ACG 2019; 114(1): 21–39.
- Hetterich L, Stengel A: Psychotherapeutic interventions in irritable bowel syndrome. Frontiers in Psychiatry 2020; 11: 286.
- Beatty L, Lambert S: A systematic review of internet-based self-help therapeutic interventions to improve distress and disease-control among adults with chronic health conditions. Clinical Psychology Review 2013; 33(4): 609–622.
- Black CJ, Thakur ER, Houghton LA et al.: Efficacy of psychological therapies for irritable bowel syndrome: systematic review and network meta-analysis. Gut 2020; 69(8): 1441–1451.
- Webb AN, Kukuruzovic RH, Catto-Smith AG, Sawyer SM.: Hypnotherapy for treatment of irritable bowel syndrome. Cochrane Database Syst Rev 2007; 4: CD005110.
- rouwel M, Farley A, Greenfield S et al.: Systematic review, meta-analysis with subgroup analysis of hypnotherapy for irritable bowel syndrome, effect of intervention characteristics. Complementary Therapies in Medicine 2021; 57: 102672.
HAUSARZT PRAXIS 2022; 17(2): 10–15
Autoren
- Marissa Bentele, M.Sc.
- Prof. Dr. med. Andreas Stengel
Publikation
- HAUSARZT PRAXIS




Comments are closed.