Eine wichtige Intervention bei tumorassoziierter Fatigue ist die Information der Patienten, dass Fatigue häufig vorkommt und die Beschwerden zwar unangenehm, aber in der Regel zumindest nicht gefährlich sind. Wenn im Lauf der Diagnostik (Mit)Ursachen für die Erschöpfung identifiziert werden können (z.B. Anämie, Depressionen oder bestimmte Medikamente), sollte nach Möglichkeit kausal therapiert werden. Zur symptomatischen Therapie stehen medikamentöse und nicht-medikamentöse Massnahmen mit Evidenz aus randomisierten Studien, systematischen Reviews und Metaanalysen zur Verfügung. Beispiele dafür sind Sport, kognitive Verhaltenstherapie, Phytopharmaka, Pychostimulanzien und Kortikosteroide. Die Therapie sollte im Sinne einer partizipativen Entscheidungsfindung an die Möglichkeiten des Patienten angepasst werden und unter Berücksichtigung von möglichen Kontraindikationen idealerweise multimodal erfolgen.
Die Tumor-Fatigue geht mit einem belastenden Gefühl unüblicher, starker Müdigkeit und Erschöpfung einher. Je nach Verlauf, Dauer und Ausprägung kann sie von vorübergehender Unpässlichkeit über unzureichende Alltagsbewältigung bis hin zur dauerhaften Erwerbsunfähigkeit führen. Zudem ist Tumor-Fatigue mit kürzeren Überlebenszeiten assoziiert. Trotz dieser teilweise gravierenden Auswirkungen wird sie oft weder als behandlungsbedürftig noch als behandlungsfähig wahrgenommen – obwohl evidenzbasierte Therapiemöglichkeiten bestehen. Abhängig vom Ergebnis der (Differenzial-)Diagnostik erfolgt die Therapie der Tumor-Fatigue (cancer-related fatigue, CrF) kausal und/oder symptomorientiert [1]. Kausale und symptomatische Therapien können unter Berücksichtigung möglicher Kontraindikationen und Arzneimittelinteraktionen kombiniert werden. Meist ist eine multimodale Behandlung nötig [2]. Jeder Behandlungsplan sollte individuell auf den Patienten abgestimmt werden und die Therapie sollte frühzeitig beginnen, um einer möglichen Chronifizierung entgegenzuwirken [3,4].
Patienten über Tumor-Fatigue informieren
Die erste wesentliche Intervention besteht darin, die Betroffenen eingehend über CrF zu informieren. Viele Patienten wissen nicht, dass es eine tumorassoziierte Fatigue gibt und sie verstehen nicht, warum sie – v.a. wenn sie als geheilt gelten – so erschöpft sind. Ängste werden wach: «Schreitet der Krebs vielleicht doch (unbemerkt) fort? Ist die (zunehmende) Müdigkeit ein Hinweis darauf, dass ich bald für immer einschlafe?» Weiterhin führt die «Unsichtbarkeit» des Phänomens dazu, dass Kontaktpersonen die Müdigkeit bagatellisieren, was von den Patienten als frustrierend erlebt wird [5]. Schon das Wissen, dass die Beschwerden einen Namen haben und dass es Möglichkeiten der Behandlung gibt, kann sehr entlastend wirken. Erfolgt die Aufklärung präventiv, z.B. bereits vor Beginn der Tumortherapie, lassen sich Ängste verhindern [4,5]. Hilfreich ist es, Patienten auf Broschüren und Informationen der Krebsliga Schweiz hinzuweisen. Interventionen können kausal oder symptomorientiert erfolgen (Abb. 1).
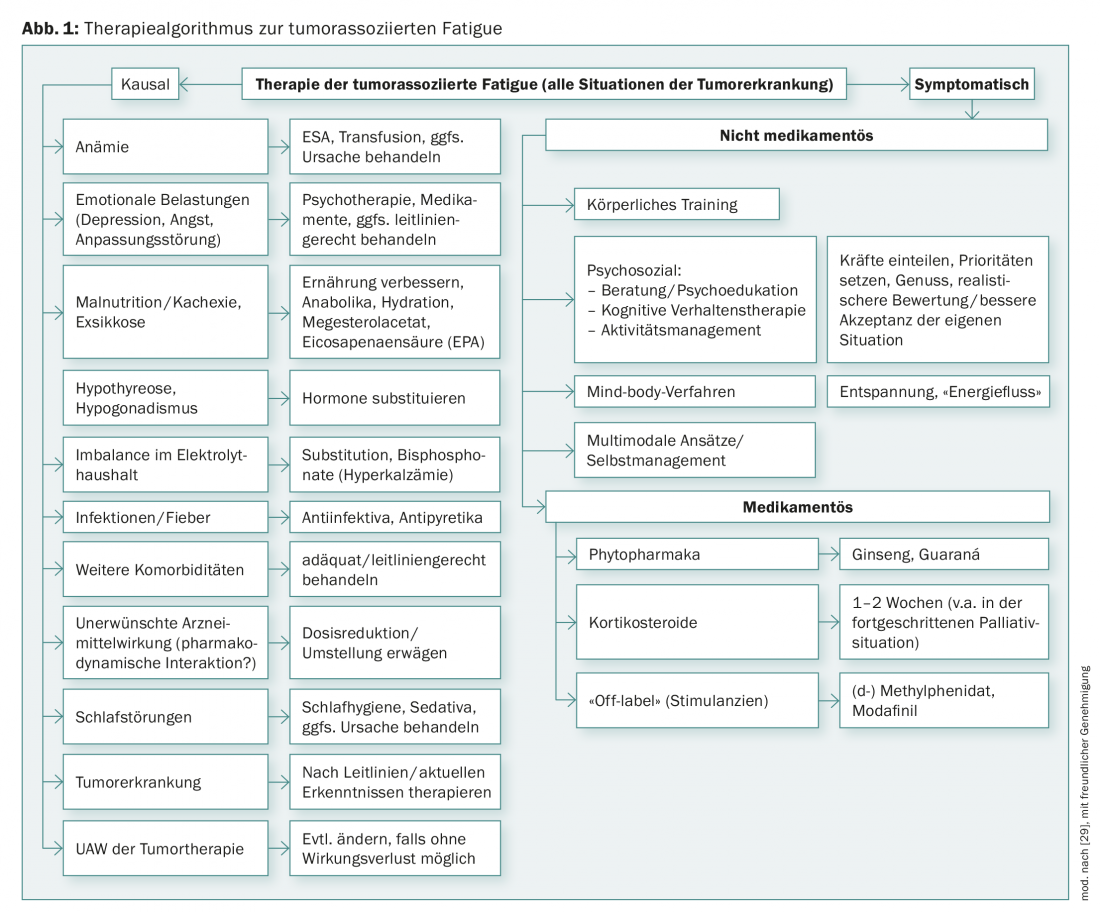
Kausaltherapie
Die kausale Therapie möglicher (Mit-)Ursachen bzw. Begleitfaktoren der tumorassoziierten Fatigue (Abb. 1) hat gegenüber einer symptomatischen Behandlung Priorität. Auch wenn es nicht immer gelingt, alle als mögliche Ursachen identifizierten Grunderkrankungen oder Funktionsstörungen zu beseitigen, kann schon ein Teilerfolg dazu beitragen, die Fatigue zu mindern und dem Patienten das Gefühl geben, dass er mit seinen Sorgen und Nöten nicht alleine gelassen wird.
Falls – in Einzelfällen – als Ursache der Tumor-Fatigue eine Anämie festgestellt wird, können Bluttransfusionen oder hämatopoetische Wachstumsfaktoren (Erythropoiesis Stimulating Agents, ESA) helfen. Durch den Einsatz von ESA werden möglicherweise das Risiko für thromboembolische Ereignisse erhöht und das progressionsfreie sowie das Gesamtüberleben verkürzt. Daher sollten sie analog zu den Empfehlungen der aktuellen Leitlinien nur bei Hb <10 g/dl, während einer myelosuppressiven Chemotherapie und bei nicht-kurativer Zielsetzung eingesetzt werden [6,7].
Wurde differenzialdiagnostisch eine unipolare Depression festgestellt, sollte diese auch leitliniengerecht behandelt werden [8]. Möglicherweise bessert sich dadurch auch die Erschöpfung. Die klinische Erfahrung zeigt aber, dass Tumorpatienten – offensichtlich ohne gründliche Diagnostik – sehr häufig Antidepressiva verordnet bekommen, obwohl sie beteuern, nicht depressiv, sondern nur müde und erschöpft zu sein. Die Verordnung von Antidepressiva ist aus ärztlicher Sicht zwar nachvollziehbar, da Müdigkeit und Erschöpfung Kernsymptome depressiver Erkrankungen und Tumorpatienten häufig auch depressiv sind, aber sie ist nicht zielführend, wenn keine Depression zugrunde liegt. In keiner der bisher durchgeführten randomisierten, placebokontrollierten Studien konnte gezeigt werden, dass Antidepressiva die tumorassoziierte Fatigue verbessern. Auch berichten Patienten mit Fatigue, die Antidepressiva (z.B. Mirtazapin oder Venlafaxin) erhalten haben, dass es ihnen dadurch nicht besser geht [9].
Grundsätze der symptomatischen Therapie
Wenn es nicht möglich ist, die tumorassoziierte Fatigue auf konkrete, behandelbare Ursachen zurückzuführen, sollten symptomorientierte Therapien angeboten werden. Sofern aus ärztlicher Sicht nichts dagegen spricht, können symptomorientierte Therapien auch kombiniert werden.
Die nachfolgenden Anregungen zu medikamentösen und nicht medikamentösen symptomatischen Behandlungen der CrF stammen aus randomisierten kontrollierten Studien, deren Zusammenfassungen in Übersichtsarbeiten oder aus Metaanalysen (entsprechend einem Evidenzlevel 1–2). Wichtige nicht medikamentöse Behandlungsoptionen sind körperliche Bewegung sowie Psychoedukation (Tab. 1). In jüngster Zeit konnte in einer randomisierten Studie auch die Wirkung für ein deutschsprachiges Selbstmanagement-Programm nachgewiesen werden [10,11].

Körperliche Aktivität/Sport
Körperliche Aktivität jeglicher Art ist eine sehr intensiv untersuchte Intervention zur Behandlung der CrF. Es konnte immer wieder gezeigt werden, dass sich CrF durch moderate körperliche Betätigung verbessern lässt. Dies gilt einer aktuellen Metaanalyse zufolge [12] sowohl für Patienten während als auch nach der Tumorbehandlung. Wichtig ist, dass sich der Patient nicht überfordert und dass die körperliche Bewegung Freude bereitet. Zur Durchführung von körperlichem Training bei Patienten mit CrF wird auf die Arbeit von Dimeo verwiesen [13]. Im Alltag bewährt hat sich die Broschüre «Fitness trotz Fatigue» (mit konkreten Übungsanleitungen und DVD) der Deutschen Fatigue Gesellschaft, die kostenlos auch von Patienten bestellt werden kann.
Psychosoziale Interventionen
Alle in Tabelle 1 aufgeführten psychosozialen Interventionen können eine CrF wirksam mindern. Psychoedukation und Beratung soll den Patienten vor allem helfen, die CrF zu verstehen [3]. Dazu gehört auch, dass die Patienten über mögliche Ursachen und therapeutische Möglichkeiten informiert werden.
Kognitive Verhaltenstherapien gehen davon aus, dass Emotionen vor allem durch die subjektive Bewertung konkreter Situationen entstehen. Der Realität angemessene (= rationale) Bewertungen führen zu adäquaten Gefühlen, realitätsunangemessene (= irrationale, katastrophisierende) Bewertungen führen zu emotionalen Problemen. Kognitive Verhaltenstherapien zielen darauf ab, zusammen mit dem Patienten dysfunktionale Bewertungen/Einstellungen zu identifizieren, zu hinterfragen und sie an die Realität anzupassen. Die kognitive Umstrukturierung erleichtert es den Patienten, besser mit ihrer Situation zurecht zu kommen. Anleitungen zum Aktivitäts- und Energiemanagement können in den Praxisalltag integriert werden.
Mind-Body-Verfahren
Yoga hat sich in einer Studie bei Brustkrebspatientinnen als wirksam erwiesen [14]. Die Autoren einer Metaanalyse, in der diese Studie noch nicht berücksichtigt wurde, schätzen die Wirkung von Yoga auf CrF insgesamt als eher schwach ein [15]. Für Akupunktur wird die Datenlage in zwei systematischen Reviews als unklar bewertet [16,17].
Selbstmanagement
In einer randomisierten Studie als wirksam erwiesen hat sich ein in Deutschland entwickeltes, aus sechs Modulen bestehendes Selbstmanagementprogramm für Patienten mit CrF [11]. Die Autorengruppe hat dazu ein Manual publiziert, das es ermöglicht, das Programm als Gruppentraining anzubieten [10]. Zusätzlich wurde auch ein Patientenratgeber erstellt [18].
Pharmakologische Therapien
Auch zur pharmakologischen Therapie der CrF ist Evidenz aus randomisierten, placebokontrollierten Studien vorhanden, und zwar für Phytopharmaka, Psychostimulantien und Kortikosteroide (Tab. 2). Für Phytopharmaka und Psychostimulantien gibt es darüber hinaus Evidenz aus systematischen Reviews und/oder Metaanalysen.

Ginseng gilt traditionell als Mittel gegen Erschöpfungszustände aller Art. Im Zusammenhang mit CrF wurden der amerikanische Ginseng (Panax quinquefolius) und der koreanische Ginseng (Panax ginseng C.A. Meyer) untersucht [19–21]. In allen Studien konnte gezeigt werden, dass Ginseng (bei guter Verträglichkeit) CrF verbessern kann. Panax ginseng ist als freiverkäufliches Arzneimittel zugelassen. Details zu Ginseng sind in der Leitlinie Komplementäre Therapie nachzulesen [22].
Guaraná (Paullinia cupana) ist eine aus Brasilien stammende Pflanze, die traditionell zur Steigerung der körperlichen und geistigen Leistungsfähigkeit verwendet wird. Der Hauptwirkstoff ist Coffein. In einer von drei Studien zur Wirksamkeit auf CrF konnte gezeigt werden, dass Guaraná bei Brustkrebspatientinnen während Chemotherapie die CrF verbessern kann [23]. Dies wird durch eine Metaanalyse mit insgesamt 137 Patienten bestätigt.
Kortikosteroide können in palliativmedizinischen Behandlungssituationen eine CrF-mindernde Wirkung haben. Daher empfiehlt u.a. die European Association for Palliative Care (EAPC), Kortikosteroide in Erwägung zu ziehen, wenn z.B. einem Patienten ein angenehmes Weihnachtsfest ermöglicht werden soll [24]. Speziell für Dexamethason konnte in einer placebokontrollierten Studie gezeigt werden, dass CrF gebessert wird [25]. Da Kortikosteroide bei längerfristigem Einsatz Myopathien induzieren und dadurch die CrF verschlechtern können, sind sie als Dauertherapie bei Patienten mit Post-Cancer-Fatigue ungeeignet. In der fortgeschrittenen palliativen Situation kann CrF ein Schutz für den Patienten sein, so dass nicht in jedem Fall therapiert werden sollte.
(Dex-)Methylphenidat (MPH): Die Studienlage für MPH ist noch widersprüchlich, aber es gibt Hinweise, dass vor allem Patienten mit einer fortgeschrittenen Tumorerkrankung, die bereits über einen längeren Zeitraum an einer ausgeprägten CrF leiden, von MPH profitieren können. Dass MPH einzelnen Patienten eindrucksvoll helfen kann, wurde auch in einer Studie der Deutschen Fatigue Gesellschaft mit retardiertem MPH bestätigt [26]. Auch mit d-MPH kann Fatigue reduziert werden [27]. Als Nebenwirkungen ist mit Schwindel, Kopfschmerzen, Blutdruckerhöhung und Mundtrockenheit zu rechnen. In den Dosierungen, die zur Zeit empfohlen werden, treten diese Nebenwirkungen eher selten auf. Entsprechend der klinischen Erfahrung kann man mit einer Dosierung von 10 mg täglich beginnen und diese nach einigen Tagen bei Nichtansprechen steigern. Kommt es auch dann innerhalb weniger Tage zu keiner Besserung, wird der Therapieversuch beendet. In der Schweiz kann der Einsatz von MPH und D-MPH nur off-label erfolgen.
Modafinil wirkt vor allem bei schwerer CrF [28]. Wegen des Auftretens schwerer psychiatrischer Symptome und kutaner Reaktionen hat die European Medicine Agency (EMA) den Einsatz von Modafinil auf die Therapie von Erwachsenen mit exzessiver Schläfrigkeit begrenzt [29].
Für die Arbeitsgemeinschaft Supportive Maßnahmen in der Onkologie, Rehabilitation und Sozialmedizin der Deutschen Krebsgesellschaft (ASORS). www.asors.de
Zweitabdruck mit freundlicher Genehmigung von Springer Medizin. Erschienen in: Im Focus Onkologie 2013; 16(9): 2–6.
Literatur:
- Fischer I: Diagnostik und Differenzialdiagnostik der Tumor-Fatigue. InFo ONKOLOGIE & HÄMATOLOGIE 2016; 4(3): 20–24.
- Heim ME, Feyer P: Das tumorassoziierte Fatigue-Syndrom. Journal Onkologie 2011; 01: 42–47.
- Weis J: Cancer-related fatigue: prevalence, assessment and treatment strategies. Expert Rev Pharmacoeconomics Outcomes Res 2011; 11(4): 441–446.
- Kuhnt S, et al.: Prädiktoren tumorassoziierter Fatigue: Längsschnittanalyse. Psychotherapeut 2011; 56: 216–223.
- Glaus A, et al.: Was Krebskranke von den Informationen über Fatigue halten: eine Beurteilung durch Patienten in der Schweiz und England. Pflege 2002; 15(5): 187–194.
- NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines®): Cancer- and Chemotherapy-Induced Anemia, Version 1.2014.
- Rizzo JD, et al.: American Society of Clinical Oncology/American Society of Hematology Clinical Practice Guideline Update on the Use of Epoetin and Darbepoetin in Adult Patients With Cancer. J Clin Oncol 2010; 28(33): 4996–5010.
- S3-Leitlinie/Nationale Versorgungsleitlinie Unipolare Depression. www.versorgungsleitlinien.de/themen/depression/pdf/s3_nvl_depression_lang.pdf.
- Fischer I, Rüffer JU: Tumor-assoziierte Fatigue oder Depression? neuro aktuell, Westermayer Verlag.
- de Vries U, et al.: Fatigue individuell bewältigen (FIBS): Schulungsmanual und Selbstmanagementprogramm für Menschen mit Krebs. Bern: Hans Huber, Hogrefe 2011.
- Reif K, et al.: A patient education program is effective in reducing cancer-related fatigue: A multi-centre randomised two-group waiting-list controlled intervention trial. Eur J Oncol Nurs 2013; 17(2): 204–213.
- Puetz TW, Herring MP: Differential effects of exercise on cancer-related fatigue during and following treatment: a meta-analysis. Am J Prev Med 2012; 43(2): e1–24.
- Dimeo FS: Körperliche Aktivität und Sport bei Tumorerkrankungen: Bewegung im eigenen Takt. Im Focus Onkologie 2010; 13(5): 60–66.
- Bower JE, et al.: Yoga for persistent fatigue in breast cancer survivors: a randomized controlled trial. Cancer 2012; 118(15): 3766–3775.
- Boehm K, et al.: Effects of yoga interventions on fatigue: a meta-analysis. Evid Based Complement Alternat Med 2012; 124703.
- He X, et al.: Acupuncture and Moxibustion for Cancer-related Fatigue: a Systematic Review and Meta-analysis. Asian Pac J Cancer Prev 2013; 14(5): 3067–3074.
- Posadzki P, et al.: Acupuncture for cancer-related fatigue: a systematic review of randomized clinical trials. Support Care Cancer 2013; 21(7): 2067–2073.
- Reif K, et al.: Wege aus der Erschöpfung: Ratgeber zur tumorbedingten Fatigue. 1st ed. Bern: Hans Huber; 2011.
- Barton DL, et al.: Ginseng (Panax quinquefolius) to Improve Cancer-Related Fatigue: A Randomized, Double-Blind Trial. J Natl Cancer Inst 2013; 105(16): 1230–1238.
- Barton DL, et al.: Pilot study of Panax quinquefolius (American ginseng) to improve cancer-related fatigue: a randomized, double-blind, dose-finding evaluation: NCCTG trial N03CA. Support Care Cancer 2010; 18(2): 179–187.
- Younus J, et al.: A double blind placebo controlled pilot study to evaluate the effect of ginseng on fatigue and quality of life in adult chemo-naïve cancer patients. J Clin Oncol 2003; 22(4): 733.
- Horneber M, Fischer I: Leitlinie Komplementäre Therapie: Ginseng. www.dghoonkopedia.de/de/onkopedia/leitlinien/komplementaere-therapie/komplementa-retherapie.pdf.
- Campos O, et al.: Guarana (Paullinia cupana) Improves Fatigue in Breast Cancer Patients Undergoing Systemic Chemotherapy. J Altern Complement Med 2011; 17(6): 505–512.
- Radbruch L, et al.: Fatigue in palliative care patients – an EAPC approach. Palliat Med 2008; 22(1): 13–32.
- Yennurajalingam S, et al.: Dexamethasone (DM) for cancer-related fatigue: A doubleblinded, randomized, placebo-controlled trial. J Clin Oncol 2012; 30(suppl): abs 9002.
- Heim ME, et al.: Randomized placebo-controlled double-blind study of modified methylphenidate on cancer-related fatigue (CRF). J Cancer Res Clin Oncol 2012; 138(Suppl. 1): 13-Abs B25–0058.
- Lower EE, et al.: Efficacy of Dexmethylphenidate for the Treatment of Fatigue After Cancer Chemotherapy: A Randomized Clinical Trial. J Pain Symptom Manage 2009; 38(5): 650–662.
- Jean-Pierre P, et al.: A phase 3 randomized, placebocontrolled, doubleblind, clinical trial of the effect of modafinil on cancerrelated fatigue among 631 patients receiving chemotherapy. Cancer 2010; 116(14): 3513–3520.
- Horneber M, et al.: Tumor-assoziierte Fatigue: Epidemiologie, Pathogenese, Diagnostik und Therapie. Dtsch Arztebl Int 2012; 109(9): 161–171.
- Roth AJ, et al.: Methylphenidate for fatigue in ambulatory men with prostate cancer. Cancer 2010; 116(21): 5102–5110.
InFo ONKOLOGIE & HÄMATOLOGIE 2016; 4(4): 21–25
Autoren
- Dr. phil. Irene Fischer
- Prof. Dr. med. Manfred E. Heim
Publikation
- INFO ONKOLOGIE & HÄMATOLOGIE




Comments are closed.