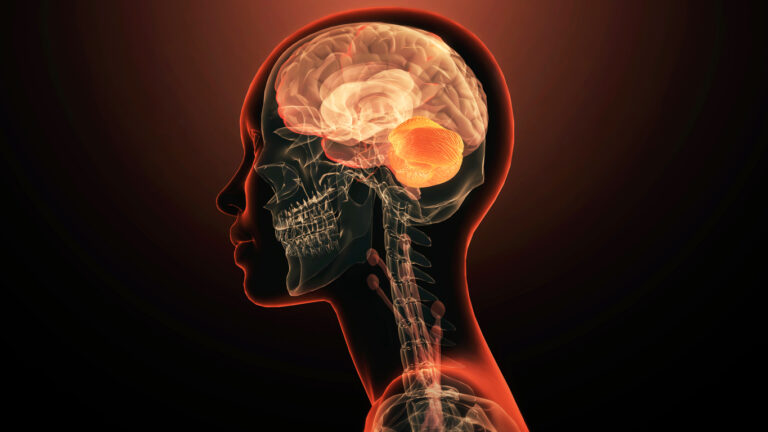
Beschreibung
Das Hallervorden-Spatz-Syndrom, auch bekannt als Pantothenatkinase-assoziierte Neurodegeneration (PKAN), ist eine seltene genetisch bedingte neurologische Störung, die durch eine abnorme Eisenanreicherung im Gehirn gekennzeichnet ist. Zu den Symptomen gehören Bewegungsstörungen wie Dystonie, Choreoathetose und Parkinsonismus sowie kognitive Beeinträchtigungen, Verhaltensänderungen und Sprachstörungen. Es gibt zwei Haupttypen des Syndroms: das klassische und das atypische Syndrom, die sich durch Unterschiede beim Auftreten und der Schwere der Symptome unterscheiden.
Das Hallervorden-Spatz-Syndrom ist äußerst selten; Schätzungen gehen von einer Inzidenz von etwa 1 bis 3 Fällen pro Million Menschen weltweit aus. Das Hallervorden-Spatz-Syndrom wurde erstmals 1922 von den deutschen Ärzten Julius Hallervorden und Hugo Spatz beschrieben, und die Pathophysiologie des Syndroms wurde seitdem durch Fortschritte in der Genforschung aufgeklärt.
Zu den Komplikationen des Hallervorden-Spatz-Syndroms gehören Atemwegsinfektionen, Aspirationspneumonie und Mobilitätsprobleme aufgrund fortschreitender Neurodegeneration. Die Diagnose umfasst eine klinische Beurteilung, bildgebende Untersuchungen wie MRT und Gentests zur Identifizierung von Mutationen im PANK2-Gen. Die Behandlung ist in erster Linie unterstützend und konzentriert sich auf das Symptommanagement durch multidisziplinäre Interventionen wie pharmakologische Behandlung, Physiotherapie und psychologische Unterstützung.
Die genetischen Ursachen des Syndroms sind in erster Linie auf Mutationen im PANK2-Gen zurückzuführen, die den Coenzym-A-Stoffwechsel stören und zu einer abnormen Eisenanreicherung im Gehirn führen. Zur Vorbeugung gehören genetische Beratung und Tests für Personen mit einer familiären Vorbelastung, während die laufende Forschung darauf abzielt, gezielte Therapien für ein besseres Management zu entwickeln. Eine frühzeitige Diagnose und ein frühzeitiges Eingreifen sind nach wie vor von entscheidender Bedeutung, um die Ergebnisse zu optimieren und die Lebensqualität der betroffenen Personen und ihrer Familien zu verbessern.
Die Biologie dahinter
Das Hallervorden-Spatz-Syndrom betrifft vor allem die Basalganglien, eine Gruppe von Strukturen, die tief im Gehirn liegen. Die Basalganglien spielen eine entscheidende Rolle bei der Steuerung von Willkürbewegungen, Kognition, Emotionen und Belohnungsverarbeitung. Eine der wichtigsten Komponenten der Basalganglien, die von dem Syndrom betroffen sind, ist der Globus pallidus, der als wichtiger Ausgangskern dient, der die motorische Aktivität moduliert, indem er thalamische Schaltkreise hemmt, die an der Bewegungsauslösung beteiligt sind.
Bei einem gesunden Menschen funktionieren die Basalganglien innerhalb eines komplexen Netzwerks miteinander verbundener Hirnregionen, um reibungslose und koordinierte Bewegungen zu ermöglichen. Dazu gehört die präzise Regulierung von Neurotransmittern wie Dopamin, Gamma-Aminobuttersäure (GABA) und Glutamat, die die neuronale Aktivität innerhalb der Basalganglien-Schaltkreise modulieren. Insbesondere Dopamin spielt eine entscheidende Rolle bei der motorischen Kontrolle und der Belohnungsverarbeitung, wobei Störungen der Dopamin-Signalübertragung bei Bewegungsstörungen wie der Parkinsonschen Krankheit eine Rolle spielen.
Beim Hallervorden-Spatz-Syndrom stören Mutationen im PANK2-Gen den Coenzym-A-Stoffwechsel, was zu einer abnormen Eisenanreicherung vor allem im Globus pallidus und in der Substantia nigra innerhalb der Basalganglien führt. Diese Eisenanhäufung löst Neurodegeneration und den fortschreitenden Verlust von Nervenzellen aus, insbesondere von solchen, die Dopamin, GABA und Glutamat enthalten. Dadurch wird das empfindliche Gleichgewicht der Neurotransmitteraktivität in den Basalganglien gestört, was zu einer Dysregulation der motorischen Funktionen, kognitiven Beeinträchtigungen und den für das Syndrom charakteristischen Verhaltensänderungen führt.
Typen und Symptome
Das Hallervorden-Spatz-Syndrom ist durch fortschreitende Bewegungsstörungen, kognitiven Verfall und neurologische Symptome gekennzeichnet. Das Verständnis der verschiedenen Symptome und potenziellen Komplikationen, die mit diesem Syndrom verbunden sind, ist für eine wirksame Behandlung und Pflege entscheidend.
Die Symptome:
Das klassische Hallervorden-Spatz-Syndrom weist ein breites Spektrum an Symptomen auf, die sowohl die motorischen als auch die kognitiven Fähigkeiten stark beeinträchtigen:
Dystonie: Bei den Betroffenen treten unwillkürliche Muskelkontraktionen auf, die zu sich wiederholenden Drehbewegungen und abnormalen Körperhaltungen führen und verschiedene Körperteile betreffen.
Choreoathetose: Kennzeichnend sind unwillkürliche, kontinuierliche Zuckungen, die häufig die Hände, Füße und das Gesicht betreffen.
Parkinsonismus-Symptome: Tremor, Steifheit und Bradykinesie können auftreten und ähneln den Symptomen der Parkinson-Krankheit.
Kognitive Beeinträchtigung: Die Betroffenen können Schwierigkeiten mit dem Gedächtnis, der Aufmerksamkeit und den exekutiven Funktionen aufweisen, was sich auf die täglichen Aktivitäten und die intellektuellen Fähigkeiten auswirkt.
Optikusatrophie: Aufgrund der Degeneration des Sehnervs kann es zu Sehstörungen oder Blindheit kommen, was den Zustand der Betroffenen weiter verkompliziert.
Komplikationen:
Komplikationen, die mit dem klassischen Hallervorden-Spatz-Syndrom einhergehen, können die Gesundheit und Lebensqualität der Betroffenen erheblich beeinträchtigen:
Atemwegsinfektionen und Aspirationspneumonie: Schluckstörungen und Mobilitätsschwierigkeiten können das Risiko von Komplikationen der Atemwege, wie z. B. Lungenentzündung, erhöhen und erfordern eine sorgfältige Überwachung und vorbeugende Maßnahmen.
Mobilitätseinschränkungen und Muskelkontrakturen: Fortschreitende Muskelschwäche und Dystonie können zu Mobilitätseinschränkungen und Muskelkontrakturen führen, die den Einsatz von Hilfsmitteln und eine kontinuierliche Physiotherapie erforderlich machen.
Stürze und Verletzungen: Menschen mit Hallervorden-Spatz-Syndrom neigen aufgrund ihrer Bewegungsanomalien zu Stürzen, wodurch sich das Risiko von Verletzungen wie Knochenbrüchen oder Kopftraumata erhöht.
Komplikationen bei der Ernährung: Schluckstörungen können zu unzureichender Ernährung und Dehydrierung führen, so dass eine Ernährungsumstellung und -unterstützung erforderlich ist.
Die Komplexität des Hallervorden-Spatz-Syndroms unterstreicht die Bedeutung umfassender Behandlungsstrategien, die sowohl auf die Symptome als auch auf mögliche Komplikationen der Erkrankung zugeschnitten sind.
Untersuchung und Diagnose
Die genaue Diagnose des Hallervorden-Spatz-Syndroms ist entscheidend für eine angemessene Behandlung und die Unterstützung der Betroffenen. Die Diagnose dieser seltenen neurologischen Störung erfordert einen umfassenden Ansatz, der klinische Untersuchungen, Labortests und bildgebende Untersuchungen umfasst.
Klinische Untersuchung:
Das medizinische Personal sammelt Informationen über die Symptome des Patienten, einschließlich des Beginns, des Verlaufs und des Schweregrads von Bewegungsstörungen, kognitiven Beeinträchtigungen und anderen neurologischen Symptomen. Eine ausführliche Anamnese kann auch Erkundigungen über die Familiengeschichte, Entwicklungsschritte und frühere neurologische Erkrankungen oder Traumata umfassen.
Die neurologische Beurteilung konzentriert sich auf die Bewertung der motorischen Funktion, einschließlich Muskeltonus, Kraft, Koordination und Reflexe. Die Untersuchung des Gangs, der Körperhaltung und unwillkürlicher Bewegungen wie Dystonie und Choreoathetose liefert wertvolle diagnostische Erkenntnisse. Darüber hinaus kann die Beurteilung der kognitiven Funktion, der Sinneswahrnehmung und der Hirnnervenfunktion dazu beitragen, das Ausmaß der neurologischen Beteiligung zu klären.
Labortests und Bildgebung:
Labortests und bildgebende Untersuchungen spielen bei der Diagnose des Hallervorden-Spatz-Syndroms eine unterstützende Rolle, da sie bei der Bewertung neurologischer Anomalien helfen und andere mögliche Ursachen ausschließen:
Magnetresonanztomographie (MRT): Die MRT des Gehirns ist ein wichtiges bildgebendes Verfahren zum Nachweis struktureller Anomalien, einschließlich Veränderungen in den Basalganglien und anderen Regionen, die mit dem Hallervorden-Spatz-Syndrom in Verbindung stehen. T2-gewichtete und Gradientenechosequenzen können charakteristische Befunde wie hypointense Signalveränderungen aufgrund von Eisenablagerungen im Globus pallidus und in der Substantia nigra aufzeigen.
Genetische Tests: Molekulargenetische Tests, wie z. B. DNA-Sequenzierung, können durchgeführt werden, um Mutationen im PANK2-Gen zu identifizieren, die mit dem Hallervorden-Spatz-Syndrom in Verbindung stehen. Die Identifizierung von pathogenen Varianten in PANK2 bestätigt die Diagnose und liefert wertvolle Informationen für die genetische Beratung.
Elektroenzephalographie (EEG): Mit Hilfe des EEG kann eine abnorme elektrische Aktivität im Gehirn festgestellt werden, insbesondere bei Personen mit Anfällen oder anderen episodischen neurologischen Symptomen, die mit dem Hallervorden-Spatz-Syndrom in Verbindung stehen. EEG-Befunde können helfen, epileptische Aktivität von anderen Ursachen für Bewegungsstörungen zu unterscheiden.
Durch Kombination der klinischen Bewertung mit relevanten Labortests und bildgebenden Untersuchungen können Gesundheitsdienstleister eine umfassende diagnostische Bewertung für Personen mit Verdacht auf das Hallervorden-Spatz-Syndrom vornehmen.
Therapie und Behandlungen
Die Behandlung des Hallervorden-Spatz-Syndroms zielt darauf ab, die Symptome zu lindern, die Lebensqualität zu verbessern und unterstützende Maßnahmen zu ergreifen. Bei diesem multidisziplinären Ansatz werden motorische und kognitive Beeinträchtigungen durch verschiedene therapeutische Maßnahmen behandelt.
Medikamentöse Behandlung:
Die Pharmakotherapie zielt auf spezifische Symptome ab:
Dystonie und Muskelkrämpfe: Anticholinergische Medikamente oder Benzodiazepine.
Parkinsonismus-Symptome: Dopaminerge Medikamente.
Psychotrope Medikamente: SSRIs oder andere Psychopharmaka.
Behandlung von Krampfanfällen: Antiepileptika (AEDs).
Physikalische Therapie:
Konzentriert sich auf Mobilität und Funktion:
Übungen für den Bewegungsumfang: Verhinderung von Kontrakturen.
Krafttraining: Verbesserung von Muskelkraft und Ausdauer.
Gehtraining: Verbesserung von Gangbild und Gleichgewicht.
Orthesen: Unterstützt geschwächte Muskeln.
Beschäftigungstherapie:
Unterstützende Geräte: Adaptive Utensilien und Kommunikationshilfen.
Training der Aktivitäten des täglichen Lebens (ADL): Strategien für das Anziehen, die Körperpflege und die Zubereitung von Mahlzeiten.
Kognitive Rehabilitation: Behebung von Defiziten im Gedächtnis und in der Handlungsfähigkeit.
Logopädie und Sprachtherapie:
Behebt Kommunikationsschwierigkeiten und Schluckstörungen:
Kommunikationsstrategien: Verbesserung der Sprachverständlichkeit.
Dysphagie-Management: Schluckübungen und Ernährungsumstellung.
Atmungstherapie:
Bewältigung von Atemwegskomplikationen:
Atemmuskeltraining: Stärkung der Atmungsmuskulatur.
Beatmungsunterstützung: NIV oder mechanische Beatmung.
Atmungstechniken: Optimierung der Atemmechanik.
Psychologische Unterstützung:
Bewältigung emotionaler und verhaltensbezogener Herausforderungen:
Beratung und Psychotherapie: Bewältigungsstrategien und Stressbewältigung.
Verhaltenstherapeutische Maßnahmen: Verbesserung der Bewältigungsfähigkeiten.
Selbsthilfegruppen: Austausch mit anderen, die ähnliche Probleme haben.
Komplementäre und alternative Therapien:
Musiktherapie: Fördert die Entspannung und die Verbesserung der Stimmung.
Kunsttherapie: Fördert den Selbstausdruck und das emotionale Wohlbefinden.
Massage-Therapie: Linderung von Muskelverspannungen und Schmerzen.
Ein umfassender, auf die individuellen Bedürfnisse zugeschnittener Ansatz ist für die Optimierung der Ergebnisse beim Hallervorden-Spatz-Syndrom unerlässlich. Die Zusammenarbeit zwischen medizinischen Fachkräften, Pflegekräften und Unterstützungsnetzwerken ist für eine ganzheitliche Behandlung entscheidend.
Ursachen und Risikofaktoren
Das Verständnis der dem Hallervorden-Spatz-Syndrom zugrunde liegenden Ursachen und Risikofaktoren ist für die Aufklärung der Pathophysiologie der Erkrankung und die Identifizierung von Personen mit einem höheren Erkrankungsrisiko von wesentlicher Bedeutung.
Ursachen:
Das Hallervorden-Spatz-Syndrom wird hauptsächlich durch Mutationen im PANK2-Gen verursacht, das für das Enzym Pantothenatkinase 2 kodiert, das an der Biosynthese von Coenzym A (CoA) beteiligt ist. CoA spielt eine entscheidende Rolle bei verschiedenen zellulären Prozessen, darunter Energiestoffwechsel, Lipidsynthese und Neurotransmitterproduktion. Mutationen im PANK2-Gen führen zu einer gestörten Funktion der Pantothenatkinase 2, was zu einem gestörten CoA-Stoffwechsel und einer Anhäufung von toxischen Substanzen, insbesondere Eisen, in bestimmten Hirnregionen wie den Basalganglien führt. Eisenablagerungen im Globus pallidus und in der Substantia nigra tragen zur neuronalen Dysfunktion, zum oxidativen Stress und zur Neurodegeneration bei, die beim Hallervorden-Spatz-Syndrom beobachtet werden. Die fortschreitende Degeneration der Neuronen in den Basalganglien und den damit verbundenen Bahnen stört die motorische Kontrolle und führt zu den für die Erkrankung charakteristischen Bewegungsstörungen, einschließlich Dystonie, Choreoathetose und Parkinsonismus.
Risikofaktoren:
Das Hallervorden-Spatz-Syndrom ist zwar in erster Linie eine genetisch bedingte Störung, doch können bestimmte Faktoren das Risiko für die Entwicklung der Krankheit erhöhen oder bestehende Symptome verschlimmern:
Genetische Mutationen: Der primäre Risikofaktor für das Hallervorden-Spatz-Syndrom ist die Vererbung von autosomal-rezessiven Mutationen im PANK2-Gen. Blutsverwandtschaft oder eine familiäre Vorbelastung mit der Erkrankung erhöht die Wahrscheinlichkeit, dass pathogene Varianten vorhanden sind.
Alter des Ausbruchs: Das Hallervorden-Spatz-Syndrom manifestiert sich typischerweise in der Kindheit oder im Jugendalter, obwohl auch Fälle im Erwachsenenalter berichtet wurden. Früh auftretende Formen der Krankheit können mit schwereren Symptomen und einem raschen Fortschreiten der Krankheit einhergehen.
Schweregrad der Erkrankung: Die spezifische Art und Lokalisierung der Mutationen im PANK2-Gen sowie der Grad der enzymatischen Funktionsstörung können den Schweregrad und die klinische Präsentation des Hallervorden-Spatz-Syndroms beeinflussen.
Umweltfaktoren: Während genetische Faktoren in erster Linie zur Entwicklung des Hallervorden-Spatz-Syndroms beitragen, können Umwelteinflüsse wie die Exposition gegenüber Toxinen oder oxidativen Stressfaktoren die neuronalen Schäden und das Fortschreiten der Krankheit bei anfälligen Personen verschlimmern.
Es ist wichtig zu beachten, dass diese Risikofaktoren zwar die Wahrscheinlichkeit der Entwicklung des Hallervorden-Spatz-Syndroms erhöhen können, aber keine Garantie für den Ausbruch der Krankheit sind, und dass auch Personen ohne diese Risikofaktoren die Krankheit entwickeln können. Ebenso führt das Vorhandensein dieser Risikofaktoren nicht unbedingt zur Entwicklung des Hallervorden-Spatz-Syndroms.
Krankheitsverlauf und Prognose
Das Verständnis des Krankheitsverlaufs und der Prognose des Hallervorden-Spatz-Syndroms ist für eine angemessene Betreuung und Unterstützung der Betroffenen von wesentlicher Bedeutung. In diesem Abschnitt werden der typische Krankheitsverlauf und die langfristigen Aussichten erläutert.
Verlauf der Krankheit:
Das Hallervorden-Spatz-Syndrom ist durch eine fortschreitende Verschlechterung der neurologischen Funktionen gekennzeichnet, die typischerweise in mehreren Phasen verläuft:
Frühe Symptome: Die ersten Symptome treten häufig in der Kindheit oder im Jugendalter auf, obwohl auch über Fälle berichtet wurde, die im Erwachsenenalter auftreten. Zu den frühen Symptomen können subtile motorische Anomalien wie Gangstörungen, Muskelsteifheit und unwillkürliche Bewegungen gehören.
Fortschreitender neurologischer Verfall: Mit dem Fortschreiten der Krankheit kann es zu einer Verschlimmerung der Bewegungsstörungen kommen, einschließlich Dystonie, Choreoathetose und Parkinsonismus. Auch ein kognitiver Abbau und psychiatrische Symptome wie Verhaltensänderungen, Depressionen und kognitive Beeinträchtigungen können auftreten.
Funktioneller Rückgang: Die fortschreitende Neurodegeneration führt zu zunehmenden Funktionseinschränkungen, die die Aktivitäten des täglichen Lebens, die Mobilität und die Unabhängigkeit beeinträchtigen. Mit dem Fortschreiten der Krankheit benötigen die Betroffenen möglicherweise Hilfe bei Aufgaben wie Anziehen, Ernährung und Kommunikation.
Fortgeschrittene Krankheit: In späteren Stadien können schwere motorische Beeinträchtigungen, einschließlich generalisierter Steifheit und Bradykinesie, zu einer tiefgreifenden Behinderung führen. Komplikationen bei der Atmung, Krampfanfälle und Schwierigkeiten bei der Nahrungsaufnahme können weiter zur Morbidität und zur Verschlechterung der Lebensqualität beitragen.
Der zeitliche Verlauf und die Geschwindigkeit des Fortschreitens der Krankheit können bei den Betroffenen sehr unterschiedlich sein, wobei bei einigen ein schnellerer Rückgang zu verzeichnen ist als bei anderen. Während der Verlauf des Hallervorden-Spatz-Syndroms im Allgemeinen progressiv ist, können die spezifischen Symptome und der Schweregrad im Laufe der Zeit schwanken, wobei sich Phasen relativer Stabilität mit Episoden der Verschlimmerung abwechseln.
Prognose:
Die Prognose für das Hallervorden-Spatz-Syndrom ist im Allgemeinen schlecht, wobei die Krankheit mit erheblicher Morbidität und Funktionseinschränkungen einhergeht. Die fortschreitende Neurodegeneration führt zu einer Verschlimmerung der motorischen und kognitiven Defizite, die schließlich zu einer tiefgreifenden Behinderung und Abhängigkeit von Pflegekräften bei den täglichen Aktivitäten führt. Die Geschwindigkeit des Fortschreitens der Krankheit und der Schweregrad der Symptome können variieren, wobei manche Menschen einen schnelleren Verfall und schlechtere Ergebnisse als andere erleben.
Leider gibt es derzeit keine Heilung für das Hallervorden-Spatz-Syndrom, und die Behandlungsmöglichkeiten konzentrieren sich auf das Symptommanagement und die unterstützende Pflege zur Optimierung der Lebensqualität. Trotz der Fortschritte in der medizinischen Versorgung und bei den Interventionen stellt der progressive Charakter der Krankheit die Betroffenen und ihre Familien vor große Herausforderungen. Die laufende Erforschung der der Krankheit zugrunde liegenden Mechanismen lässt jedoch auf künftige therapeutische Entwicklungen hoffen, die das Fortschreiten der Krankheit verlangsamen und die Behandlungsergebnisse verbessern sollen.
Prävention
Präventionsstrategien spielen eine entscheidende Rolle bei der Minderung des Risikos des Hallervorden-Spatz-Syndroms und der Verringerung der Krankheitslast für die Betroffenen und ihre Familien. Zwar gibt es derzeit keine spezifischen Maßnahmen zur Vorbeugung der mit der Krankheit verbundenen genetischen Mutationen, doch mehrere Ansätze konzentrieren sich auf die Minimierung von Umweltfaktoren und die Optimierung des allgemeinen Gesundheitszustands, um das Krankheitsrisiko potenziell zu verringern.
Genetische Beratung und Tests:
Personen mit einer Familienanamnese des Hallervorden-Spatz-Syndroms oder bekannte Träger von PANK2-Genmutationen können von einer genetischen Beratung und einem Gentest profitieren. Die genetische Beratung informiert über das Vererbungsmuster, die Risikofaktoren und die verfügbaren Testmöglichkeiten, so dass die Betroffenen fundierte Entscheidungen über Familienplanung und Reproduktionsmöglichkeiten treffen können. Durch Gentests können Träger von pathogenen Varianten im PANK2-Gen identifiziert werden, was eine frühzeitige Erkennung und Beratung von Risikopersonen und ihren Familien ermöglicht.
Pränatales Screening:
Pränatale Screening-Techniken wie die Chorionzottenbiopsie (CVS) oder die Fruchtwasseruntersuchung können schwangeren Personen mit einer Familienanamnese des Hallervorden-Spatz-Syndroms oder bekannten Trägern von PANK2-Genmutationen angeboten werden. Mit diesen diagnostischen Tests können genetische Anomalien beim Fötus in einem frühen Stadium der Schwangerschaft festgestellt werden, so dass die Eltern fundierte Entscheidungen über das Schwangerschaftsmanagement und mögliche Interventionen treffen können.
Vermeiden von Umweltgiften:
Während genetische Faktoren in erster Linie zur Entwicklung des Hallervorden-Spatz-Syndroms beitragen, kann die Minimierung der Exposition gegenüber Umweltgiften und oxidativen Stressfaktoren dazu beitragen, neuronale Schäden und das Fortschreiten der Krankheit zu verringern. Der Einzelne kann proaktive Maßnahmen ergreifen, um die Exposition gegenüber Schadstoffen, Schwermetallen und anderen neurotoxischen Substanzen in der Umwelt zu vermeiden, einschließlich Luftverschmutzung, Industriechemikalien und bestimmten Medikamenten.
Gesunde Lebensweise:
Die Aufrechterhaltung der allgemeinen Gesundheit und des Wohlbefindens durch eine gesunde Lebensweise kann die neurologische Funktion unterstützen und das Risiko neurodegenerativer Erkrankungen wie des Hallervorden-Spatz-Syndroms verringern. Strategien wie regelmäßige Bewegung, ausgewogene Ernährung, ausreichender Schlaf und Stressbewältigung können die Gesundheit des Gehirns fördern und die kognitiven Funktionen optimieren. Der Verzicht auf übermäßigen Alkoholkonsum, Rauchen und illegalen Drogenkonsum wird ebenfalls empfohlen, um mögliche neurotoxische Auswirkungen zu minimieren.
Forschung und Frühintervention:
Die fortgesetzte Erforschung der dem Hallervorden-Spatz-Syndrom zugrunde liegenden Mechanismen kann die Entwicklung gezielter Therapien und Eingriffe erleichtern, die den Ausbruch der Krankheit verhindern oder ihr Fortschreiten verlangsamen. Frühzeitige Interventionsstrategien, die sich auf Symptommanagement, Rehabilitation und unterstützende Pflege konzentrieren, können dazu beitragen, die Ergebnisse für Personen, bei denen die Krankheit diagnostiziert wurde, zu optimieren.
Zusammenfassung
Das Hallervorden-Spatz-Syndrom, heute eher als Pantothenatkinase-assoziierte Neurodegeneration (PKAN) bezeichnet, ist eine seltene, genetisch bedingte neurologische Erkrankung, die durch eine Anhäufung von Eisen im Gehirn gekennzeichnet ist und zu einer Reihe von Symptomen wie Bewegungsstörungen (Dystonie, Choreoathetose, Parkinsonismus), kognitiven Beeinträchtigungen, Verhaltensänderungen und Sprachstörungen führt. PKAN wird durch Mutationen im PANK2-Gen verursacht, die die Funktion der Basalganglien beeinträchtigen und zu einer fortschreitenden Neurodegeneration führen, die sich in klassische und atypische Formen unterteilt. Die Diagnose stützt sich auf eine klinische Bewertung, MRT und genetische Tests, wobei sich die Behandlung auf das Symptommanagement und multidisziplinäre Unterstützung konzentriert. Trotz ihrer Seltenheit – die Häufigkeit wird auf 1 bis 3 Fälle pro Million Menschen weltweit geschätzt – stellt die PKAN erhebliche Herausforderungen in Bezug auf Mobilität, Ernährung und Atemwegsgesundheit dar und erfordert daher umfassende Behandlungsstrategien. Eine frühzeitige Diagnose und ein frühzeitiges Eingreifen sind für die Verbesserung der Lebensqualität von entscheidender Bedeutung, was die Bedeutung der genetischen Beratung von Risikopersonen und der laufenden Forschung nach gezielten Therapien unterstreicht.