Eine über Jahre bestehende ungenügend behandelte arterielle Hypertonie führt meist zu einer Herzinsuffizienz. Es ist keineswegs überraschend, dass das Auftreten einer Herzinsuffizienz durch die Behandlung des Blutdruckes, des Übergewichts und der Diabetes hinausgezögert werden kann.
Eine über Jahre bestehende ungenügend behandelte arterielle Hypertonie führt meist zu einer Herzinsuffizienz, wenn es unterdessen zu keiner anderen lebenslimitierenden Erkrankung kommt. Umgekehrt besteht bei Patienten mit Herzinsuffizienz häufig bereits über Jahre vorher eine arterielle Hypertonie. In der Framingham-Kohorte hatten über einen Beobachtungszeitraum von 20 Jahren 91% aller Patienten mit einer neu diagnostizierten Herzinsuffizienz vorgängig bereits die Diagnose einer arteriellen Hypertonie [1]. Das Risiko für die Entwicklung einer Herzinsuffizienz in hypertensiven verglichen zu normotensiven Studienteilnehmern, korrigiert für Alter und andere Herzinsuffizienz auslösende Faktoren, war für Männer zwei Mal und für Frauen drei Mal höher. Risikofaktoren für Herzinsuffizienz sind zum Beispiel Herzinfarkt, Diabetes mellitus, linksventrikuläre Hypertrophie und Klappenerkrankungen. Das Risiko, eine Herzinsuffizienz zu entwickeln, verdoppelt sich bei Patienten mit einem Blutdruck von 160/100 mmHg im Vergleich zu solchen mit 140/90 mmHg [2].
Somit ist es keineswegs überraschend, dass das Auftreten einer Herzinsuffizienz durch die Behandlung des Blutdruckes, des Übergewichts und des Diabetes hinausgezögert werden kann. Männer resp. Frauen ohne Hypertonie, ohne Übergewicht und ohne Diabetes im Alter von 45 Jahren leben im Durchschnitt 3 bis 15 Jahre länger ohne das Auftreten von Herzinsuffizienz im Vergleich zu Patienten mit solchen Risikofaktoren [3]. Ein normales Körpergewicht, kein Diabetes und insbesondere fehlende arterielle Hypertonie sind mit einem 86% tieferen Risiko für das Auftreten einer Herzinsuffizienz im Laufe des Lebens assoziiert. In der SHEP (Systolic Hypertension in the Elderly Program) Studie verlängerte sich während eines Beobachtungszeitraumes von 4,5 Jahren, das Leben um einen Tag pro Monat bei Patienten unter Chlorthalidon im Vergleich zu solchen unter Placebo [4].
Pathophysiologie
Die diastolische Dysfunktion ist die erste Manifestation der hypertensiven Kardiopathie. Kardiales Remodelling aufgrund einer Druckbelastung (z.B. arterielle Hypertonie, Aortenstenose) führt aufgrund des Laplace-Gesetzes zu konzentrischer linksventrikulärer Hypertrophie. Zur Kompensation der durch den Druck erhöhten Wandspannung verdickt sich der Muskel und das Cavum des Ventrikels wird kleiner. Im Gegensatz dazu führt eine Volumenbelastung (z.B. Aortenklappeninsuffizienz, Adipositas, chronische Niereninsuffizienz, Anämie) zu einer exzentrischen Hypertrophie des linken Ventrikels (Zunahme des Ventrikelvolumens und vermehrte Muskelmasse) [5].
Wenn die Druckbelastung anhält, die diastolische Dysfunktion zunimmt und der konzentrische hypertrophe linke Ventrikel dekompensiert, kommt es zur Herzinsuffizienz mit erhaltener linksventrikulärer systolischer Funktion (HFpEF – «heart failure with preserved ejection fraction»). Im Gegensatz dazu kommt es bei einem linken Ventrikel mit exzentrischer Hypertrophie, wenn die Volumenbelastung anhält, und der linke Ventrikel dekompensiert zu Herzinsuffizienz mit reduzierter linksventrikulärer Funktion (HFrEF – «heart failure with reduced ejection fraction»).
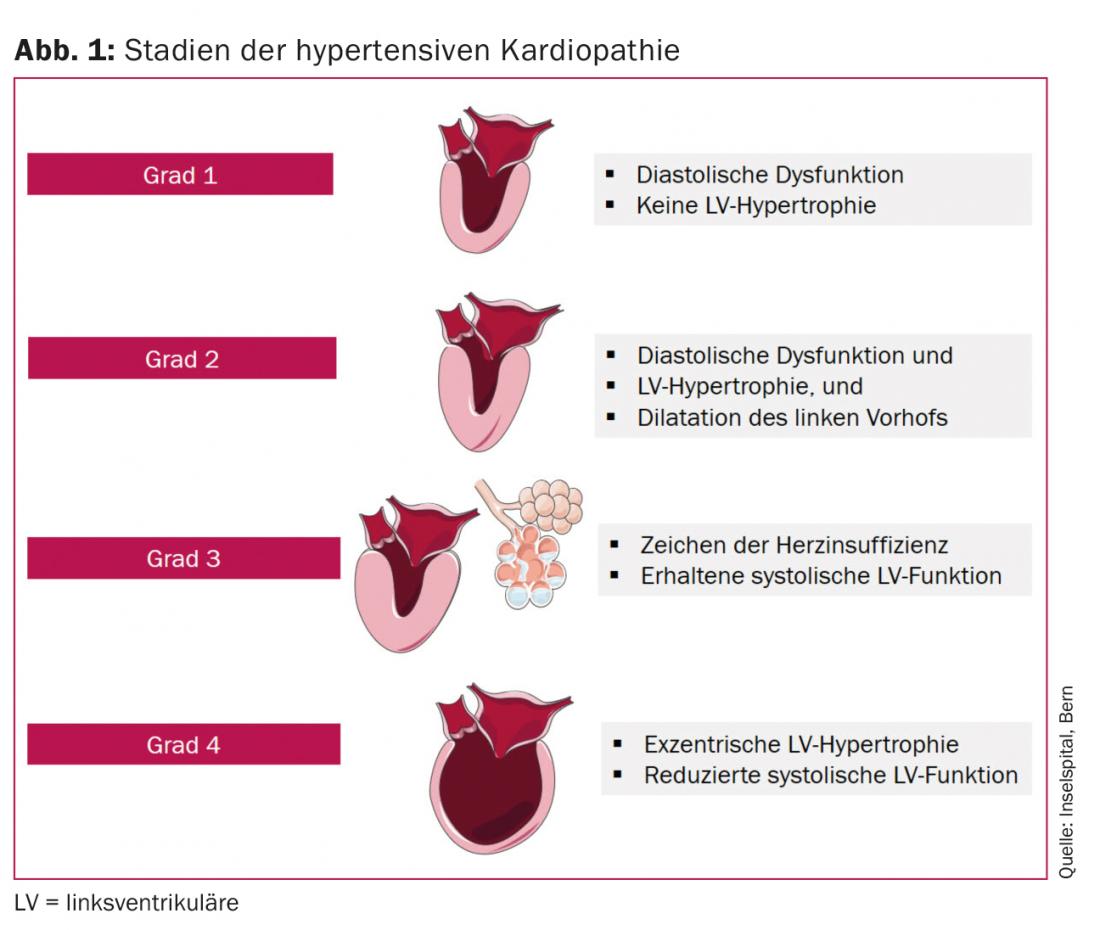
Linksventrikuläre (LV) Hypertrophie und erhöhte Biomarker für subklinischen Myokardschaden (high-sensitivity Troponin, N-terminal pro-B-type natriuretic peptide [NT-pro BNP]) sind mit einem höheren Risiko bezüglich Entwicklung einer symptomatischen Herzinsuffizienz, insbesondere HFrEF assoziiert [6]. Bei HFpEF sind die Werte von NT-pro BNP meist tiefer, was durch einen geringeren Wandstress und somit weniger zirkulierende natriuretische Peptide erklärt wird [7]. In 30% aller Patienten mit HFpEF finden sich normale natriuretische Proteine [8], insbesondere in Patienten mit Adipositas [9] oder mit Symptomen lediglich unter Belastung [10]. Schlussendlich ist das Endstadium einer hypertensiven Kardiopathie, normalerweise das Resultat einer über Jahre bestehenden Druck- und Volumenbelastung, die dilatative Kardiopathie. Von einem klinischen Standpunkt aus gesehen, kann die hypertensive Kardiopathie in vier Stadien eingeteilt werden (Abb. 1):
- Grad 1: Diastolische Dysfunktion des linken Ventrikels ohne LV-Hypertrophie
- Grad 2: Diastolische Dysfunktion des linken Ventrikels mit LV-Hypertrophie
- Grad 3: Symptome der Herzinsuffizienz (Dyspnoe, Lungenödem) bei erhaltener systolischer LV-Funktion
- Grad 4: Dilatative Kardiopathie mit eingeschränkter systolischer LV-Funktion und Symptomen der Herzinsuffizienz [11].
Die diastolische Dysfunktion ist die häufigste Auswirkung einer langjährig bestehenden Hypertonie. Jedoch nicht alle Patienten mit diastolischer Dysfunktion weisen eine HFpEF auf [12], und die diastolische Dysfunktion kann bei gut behandelten Patienten mit HFpEF oder bei Patienten, welche primär bei Belastung Beschwerden aufweisen, ganz fehlen [10,13]. Der linke Vorhof ist häufig dilatiert und der mittels Doppler geschätzte systolische pulmonale Druck ist erhöht (>35 mmHg) [14]. Patienten mit HFpEF zeigen vermehrt LV-Hypertrophie, Läsionen in den epikardialen Koronarien, Abnahme der koronaren Mikrozirkulation und myokardiale Fibrose als ein Kontrollkollektiv. Ursächlich für die Störung der koronaren Mikrozirkulation könnte eine vermehrte systemische Inflammation und oxidativer Stress aufgrund der Komorbiditäten der HFpEF sein [15,16].
Sogar eine isolierte diastolische Dysfunktion kann erstaunlicherweise ein Lungenödem auslösen, wie durch Gandhi et al. gezeigt [17]. Patienten mit einer Episode eines hypertensiv bedingten Lungenödems zeigten während und danach, als der Blutdruck gut kontrolliert war, eine unverändert normale systolische linksventrikuläre Funktion. Der mittlere systolische Blutdruck war initial 200 +/– 26 mmHg während des Lungenödems und 139 +/– 17 mmHg zum Zeitpunkt der Verlaufskontrolle. Als einzige Ursache für das Lungenödem verblieb die diastolische Dysfunktion, da eine transiente systolische Dysfunktion mit oder ohne Mitralinsuffizienz bei diesen Patienten fehlte [17].
«Ausgebrannte» hypertensive Kardiopathie
In einer fortgeschrittenen Herzinsuffizienz ist der systolische Blutdruck häufig tief, sogar bei Patienten, welche bisher immer hyperton waren. Dieses Phänomen wird als «ausgebrannte» hypertensive Kardiopathie bezeichnet. Patienten mit langjährig bestehender Hypertonie können zunehmend normo- bis hypoton werden, wenn die Herzinsuffizienz zunimmt, sprich die systolische LV-Funktion abnimmt. Eine schwer eingeschränkte systolische LV-Funktion führt zu einem verminderten Herzminutenvolumen, wobei kompensatorische Mechanismen wie periphere Vasokonstriktion das Herzminutenvolumen nicht erhalten und somit auch den Abfall des Blutdruckes nicht aufhalten können. Patienten mit «ausgebrannter» hypertensiver Kardiopathie tolerieren Blutdruck-senkende Medikamente wie Angiotensin-Rezeptor-Blocker (ARB), Angiontensin-Converting-Enzyme (ACE)-Hemmer, Betablocker (BB) und Diuretika nur schlecht.
Das Zwischenspiel von hohem Blutdruck, hypertensiver Kardiopathie und dilatativer Kardiopathie (als Zeichen einer «ausgebrannten» hypertensiven Kardiopathie, sprich dem Endstadium der hypertensiven Kardiopathie) ist komplex. Häufig zeigt sich erst retrospektiv, dass die arterielle Hypertonie (mit-)ursächlich für die dilatative Kardiopathie war. Falls sich die systolische LV-Funktion erholt, so steigt auch wieder der Blutdruck an.
Arterielle Hypertonie bei Patienten mit HFrEF
Auch wenn die arterielle Hypertonie ein bekannter Risikofaktor für Herzinsuffizienz ist, scheint ein hoher systolischer Blutdruck bei HFrEF-Patienten mit tieferer Mortalität assoziiert zu sein. Mehrere Studien zeigten ein verbessertes Outcome bei hohem systolischen Blutdruck bei Patienten mit akuter wie auch chronischer Herzinsuffizienz [18–24]. So war auch in 2289 Patienten in der COPERNICUS-Studie (Carvedilol Prospective Randomized Cumulative Survival) ein tieferer systolischer Blutdruck mit einem höheren Risiko für Tod assoziiert [25]. Mitursächlich für den positiven Effekt der Betablocker-Therapie auf das Überleben bei Herzinsuffizienz könnte auch die Zunahme des zentralen Blutdruckes sein. Entsprechend ist die Abnahme der Herzfrequenz unter Betablocker-Therapie (welche indirekt proportional zur Zunahme des zentralen Druckes ist) bei Patienten mit Herzinsuffizienz in der SHEP-Studie mit einem besserem Überleben assoziiert [26]. Das gleiche Phänomen könnte auch auf Ivabradine zutreffen, wo in der SHIFT-Studie («Systolic Heart failure treatment with the If inhibitor ivabradine») eine Reduktion der Hospitalisationen für Herzinsuffizienz erzielt werden konnte [27]. Im Kontrast zum normalen hypertensiven Patienten, wo eine Reduktion der Herzfrequenz mit vermehrter kardiovaskulärer Mortalität assoziiert ist, trifft bei Patienten mit Herzinsuffizienz das Gegenteil zu [26,28].
Kardiorenales Syndrom
Sowohl im Herz, wie auch in der Niere kommt es bei langjährig bestehender arterieller Hypertonie zu Endorganschäden. So kommt es bei diesen Patienten nicht nur zur Herz-, sondern auch zu Niereninsuffizienz. Die Interaktion zwischen Herz und Niere verläuft in beide Richtungen über verschiedenste Mechanismen [29]. Die häufigsten kardiorenalen Syndrome bei Herzinsuffizienz-Patienten sind die folgenden [30]:
- Typ 1 (akut): Akute Herzinsuffizienz führt zu akutem Nierenschaden (Niereninsuffizienz)
- Typ 2 (chronisch): Chronische Herzinsuffizienz führt zu zunehmender Erkrankung der Niere
- Typ 3: Akute Verschlechterung der Nierenfunktion führt zu Herzinsuffizienz
- Typ 4: Auftreten einer Herzinsuffizienz aufgrund einer zunehmenden renalen Grunderkrankung
Aus Sicht des Klinikers erschwert das Auftreten einer Niereninsuffizienz die Therapie der Herzinsuffizienz. Wenn die Niereninsuffizienz fortschreitet, kommt es zu vermehrter Herzinsuffizienz, wie auch umgekehrt. Entsprechende Komorbiditäten und viele Medikamente für die Herzinsuffizenz erhöhen das Risiko für eine Hyperkaliämie. Ein ausgeprägtes kardiorenales Syndrom schränkt die Medikamentenwahl und deren Aufdosierung auf die Zieldosis drastisch ein. Eine Kombination von neu erforschten K+-Bindern (z.B. Patiromer) und eines Mineralkortikoidantagonisten könnte zukünftig die kardiovaskuläre Mortalität und Morbidität in Patienten mit Herzinsuffizienz reduzieren [31].
Pickering-Syndrom
1988 berichteten Dr. Pickering et al. über elf Patienten mit Hypertonie und bilateraler atherosklerotischer Nierenarterienstenose, welche sich mit mehreren Episoden von plötzlich aufgetretenen Lungenödem präsentierten [32]. Das Pickering-Syndrom, plötzlich auftretendes Lungenödem («flash pulmonary edema») und bilaterale Nierenarterienstenose, ist ein kardiorenales Syndrom Typ 3. Patienten mit Pickering-Syndrom präsentieren sich meist mit diastolischer Dysfunktion und LV-Hypertrophie, die systolische LV-Funktion ist normal oder nur leicht eingeschränkt. Dies, zusammen mit einer ungenügenden Natriurese aufgrund der bilateralen Nierenarterienstenose, ist der Mechanismus, welcher zum Lungenödem führt (Abb. 2). Die Tatsache, dass dieses Lungenödem plötzlich auftritt und zu einem lebensbedrohlichen Notfall führt, unterscheidet das Pickering-Syndrom von anderen Formen der kardialen Dekompensation [33]. Rezidivierende plötzlich auftretende Lungenödeme, fehlende typische Angina, erhöhter Blutdruck und erhöhte Kreatininwerte sollten an eine bilaterale Nierenarterienstenose, sprich ein Pickering-Syndrom, als Ursache für das plötzliche Lungenödem denken lassen. In den Fallserien zum Pickering-Syndrom ist es vorgängig meist zu mehreren plötzlich auftretenden Lungenödemen gekommen, bis die Diagnose der bilateralen Nierenarterienstenosen gestellt wurde [32].
Das Ziel der akuten Behandlung des plötzlich auftretenden Lungenödems ist, eine genügende Oxygenierung zu erreichen mittels Senkung der Nachlast zum Senken des postkapillären Wedge-Druckes und Aufrechterhaltung einer genügenden Diurese. Das Beheben der Ursache, sprich eine Angioplastie der Nierenarterienstenose, ist essenziell, sobald der Patient stabilisiert wurde.
Antihypertensive Therapie zur Reduktion der Inzidenz der Herzinsuffizienz
Per Definition reduzieren alle antihypertensiven Medikamente den Blutdruck. Aber, wenn man die Literatur genau betrachtet, sind nicht alle Medikamente gleich gut geeignet, die Inzidenz der Herzinsuffizienz zu reduzieren. Betablocker sind ein Grundstein der Therapie der Herzinsuffizienz mit reduzierter systolischer LV-Funktion (HFrEF) [34]. Im Vergleich zu den anderen antihypertensiven Medikamenten haben sie aber keinen besseren präventiven Charakter bezüglich Herzinsuffizienz. In 112 177 Patienten aus zwölf unterschiedlichen randomisierten kontrollierten Studien führte eine Therapie mit BB wohl zu einer Reduktion des Blutdrucks von 12,6/6,1 mmHg im Vergleich zum Placebo. Es fand sich aber keine signifikante Reduktion der Inzidenz von Herzinsuffizienz [35]. Verglichen mit anderen antihypertensiven Medikamenten bringen BB keinen zusätzlichen Effekt bezüglich Reduktion der Gesamtmortalität, kardiovaskulärer Mortalität oder Herzinfarkt. Es kommt aber zu einer Zunahme von Hirnschlagprävalenz bei älteren Patienten. Daher sollten BB nicht die erste Wahl einer antihypertensiven Therapie sein.
In einer Cochrane Meta-Analyse erhöhten Kalziumkanalbocker (CCB) das Risiko für Herzinsuffizienz (Risk Ratio [RR]: 1,37; 95% Konfidenzintervall (KI): 1,25–1,51) im Vergleich zu Diuretika. Auch wenn CCB im Vergleich zu ACE-Hemmern das Risiko für Hirnschlag und im Vergleich zu ARB das Risiko für Herzinfarkt und Hirnschlag reduzieren, scheint es unter CCB vermehrt zu Herzinsuffizienz zu kommen im Vergleich zu den ACE-Hemmern (RR 1,16; 95% KI 1,06–1,27) und auch im Vergleich zu den ARB (RR 1,2, 95% KI: 1,06–1,36) [36]. Eine aktuelle Metanalyse stellt dies aber in Frage: Darin scheint eine Blutdruckreduktion mittels CCB das Auftreten einer Herzinsuffizienz ebenso effizient vorzubeugen wie eine Blutdrucksenkung mit anderen Medikamenten [37]. Somit könnte die vorgängig nachgewiesene Inferiorität der CCB durch eine bessere Begleit-Medikation im Kontrollarm entstanden sein.
In der ALLHAT (Antihypertensive and Lipid-Lowering Treatment to Prevent Heart Attack Trial) Studie kam es unter dem Alpha-Blocker Doxazosin im Vergleich zu Chlorthalidon häufiger zu Hirnschlag und kardiovaskulären Erkrankungen. Das Risiko für Herzinsuffizienz unter Doxazosin-Therapie war doppelt so hoch (RR 2,04, 95% KI 1,79–2,32, p>0,001) [35]. Somit scheint es, dass eine Behandlung mit Alphablockern bei Patienten mit Risiko bezüglich Herzinsuffizienz vermieden werden sollte.
Die Blockade des Renin-Angiotensin-Systems führt zu einer effizienten Senkung des Blutdrucks und reduziert die Inzidenz einer Herzinsuffizienz. ACE-Hemmer sind ebenso effizient wie ARB [38,39]. Hier ist insbesondere auf den neu zugelassenen ARB/Neprilysin-Inhibitor Valsartan/Sacubitril hinzuweisen, welcher nicht nur ein potentes Medikament in der Behandlung der Herzinsuffizienz mit reduzierter systolischer LV-Funktion ist, sondern wahrscheinlich auch gut den Blutdruck senkt [40]. In der PARADIGM-Studie (Prospective Comparision of ARNI with ACEI to Determine Impact on Global Mortalitiy and Morbidity in Heart Failure) zeigte Valsartan/Sacubitril eine durchschlagende Reduktion der kardiovaskulären Mortalität und Morbidität in Patienten mit reduzierter systolischer LV-Funktion [41]. Ob Valsartan/Sacubitril auf lange Sicht bei Hypertonikern ein gutes Nutzen-Risiko-Verhältnis ausweist, muss sich erst aber zeigen.
Zu guter Letzt sind Thiazid-ähnliche Diuretika wie Chlorthalidon oder Indapamid eine ausgezeichnete Wahl der antihypertensiven Medikation zur Prävention der Herzinsuffizienz. In der SHEP-[42] wie auch in der HYVET (Hypertension in the Very Elderly Trial)-Studie [43] führten diese zu einer signifikanten Reduktion der Herzinsuffizienz im Vergleich zu Placebo, für Chlorthalidon (RR 0,51; 95% KI 0,37–0,71) und für Indapamid (RR 0,36; 95% KI 0,22–0,58; p<0,001). Thiazid-ähnliche Diuretika sind in zehn randomisierten kontrollierten Studien allen anderen antihypertensiven Medikamenten bezüglich Prävention der Herzinsuffizienz überlegen (RR 0,84; 95% KI 0,73–0,98) [37]. Solche Resultate gibt es aber nicht für Hydrochlorothiazid, weder für Herzinsuffizienz noch für irgendeinen anderen kardiovaskulären Endpunkt. Im Gegensatz zu Indapamid oder Chlorthalidon sollte Hydrochlorthiazid in Hypertonikern mit einem Risiko für Herzinsuffizienz somit vermieden werden.
In der TOPCAT-Studie (Treatment of Preserved Cardiac function Heart Failure with an Aldosterone Antagonist), bei Patienten mit HFpEF, hatte der Aldosteron-Antagonist Spirinolactone keinen Einfluss auf einen Composite-Endpunkt von kardiovaskulärem Tod oder Hospitalisation [44]. Spirinolacton-Therapie führte jedoch zu einer Reduktion der Anzahl Hospitalisationen aufgrund von Herzinsuffizienz, aber auch zu einer Zunahme von Niereninsuffizienz und Hyperkaliämie. In einer Post-hoc-Analyse mit lediglich Patienten vom nordamerikanischen Kontinent zeigt sich aber ein positiver Composite-Endpunkt [45]. Erstaunlicherweise kam es in Georgien und Russland zu vermehrten Endpunkten in der Interventionsgruppe im Vergleich zur Kontrollgruppe. Schaut man dann im Blut nach Metaboliten des Spirinolactons, so war dieser bei 30% der Patienten in Russland, welche das Medikamente einnehmen sollten, nicht nachweisbar, im Vergleich zu 3% in Nordamerika [46].
Zusammengefasst verlangsamen die meisten antihypertensiven Medikamentenklassen die Transition von der Hypertonie zur Herzinsuffizienz, wenn auch nicht alle Klassen diesbezüglich gleich effizient sind. Einmal täglich verabreichtes Hydrochlorothiazid sollte vermieden werden, insbesondere da mit Chlorthalidion und Indapamid zwei sehr gute Alternativen zur Verfügung stehen.
Antihypertonika bei Patienten mit Herzinsuffizienz und weiterhin hohen Blutdruckwerten
Meist ist bei Patienten mit Herzinsuffizienz [47] ein tiefer Blutdruck das häufigere Problem. Manchmal kommt es aber bei Patienten mit HFpEF, seltener in HFrEF, zu persistierender Hypertonie. Aufgrund fehlender Evidenz sind unsere Empfehlungen empirisch, basierend auf klinischen und pathophysiologischen Überlegungen [48]. Diese Empfehlungen gelten für Patienten, die trotz Therapie mit ausdosiertem ACE-Hemmer oder ARB, Betablocker und Diuretikum weiterhin erhöhte Blutdruckwerte (>140/90 mmHg in der Praxis/Spital) aufweisen.
Als Erstes sollte immer eine Therapieadhärenz kontrolliert werden. Ziel des weiteren Ausbaus der Therapie nach Betablocker, ACE-Hemmer oder ARB und Schleifendiuretika ist es in HFpEF die diastolische und mikrovaskuläre Dysfunktion zu verbessern und in HFrEF die eingeschränkte systolische linksventrikuläre Funktion zu erhalten oder möglicherweise zu verbessern. In Abbildung 3findet sich unsere Empfehlung mit initial vermehrter Nachlastsenkung mit Valsartan/Sacubitril anstelle des ACE-Hemmer/ARB und einem Wechsel auf einen vasodilatativen Betablocker wie Carvedilol oder Nebivolol. Auch sollte bei Patienten mit HFpEF und weiterhin hohen Blutdruckwerten ein Statin begonnen werden.
Take-Home-Messages
- 90% aller Patienten mit einer neu diagnostizierten Herzinsuffizienz hatten vorgängig eine arterielle Hypertonie.
- Die diastolische Dysfunktion, linksventrikuläre Hypertrophie und Dilatation des linken Vorhofes sind die Zeichen der hypertensiven Kardiopathie.
- In 30% aller Patienten mit Herzinsuffizienz mit erhaltener systolischer Funktion finden sich normale natriuretische Peptide, insbesondere bei adipösen Patienten.
- Bei einer dilatativen Kardiopathie (im Rahmen einer «ausgebrannten» hypertensiven Kardiopathie) zeigt sich häufig erst retrospektiv nach Erholung der systolischen LV-Funktion, dass die Hypertonie ursächlich war.
- ACE-Hemmer, Angiotensin-Rezeptor-Blocker und Indapamid oder Chlorthalidon sind die antihypertensiven Medikamente der Wahl zur Vermeidung einer Herzinsuffizienz.
Literatur:
- Levy D, Larson MG, et al.: The progression from hypertension to congestive heart failure. JAMA 1996; 275: 1557–1562.
- Lloyd-Jones DM, Larson MG, et al.: Lifetime risk for developing congestive heart failure: the Framingham Heart Study. Circulation 2002; 106: 3068–3072.
- Ahmad FS, Ning H, et al.: Hypertension, Obesity, Diabetes, and Heart Failure-Free Survival: The Cardiovascular Disease Lifetime Risk Pooling Project. JACC Heart Fail 2016; 4: 911–919.
- Kostis JB, Cabrera J, et al.: Association between chlorthalidone treatment of systolic hypertension and long-term survival. JAMA 2011; 306: 2588–2593.
- Messerli FH: Cardiovascular effects of obesity and hypertension. Lancet 1982; 1: 1165–1168.
- Seliger SL, de Lemos J, et al.: Older Adults, «Malignant» Left Ventricular Hypertrophy, and Associated Cardiac-Specific Biomarker Phenotypes to Identify the Differential Risk of New-Onset Reduced Versus Preserved Ejection Fraction Heart Failure: CHS (Cardiovascular Health Study). JACC Heart Fail 2015; 3: 445–455.
- Iwanaga Y, Nishi I, et al.: B-type natriuretic peptide strongly reflects diastolic wall stress in patients with chronic heart failure: comparison between systolic and diastolic heart failure. J Am Coll Cardiol 2006; 47: 742–748.
- Anjan VY, Loftus TM, et al.: Prevalence, clinical phenotype, and outcomes associated with normal B-type natriuretic peptide levels in heart failure with preserved ejection fraction. Am J Cardiol 2012; 110: 870–876.
- Bishu K, Deswal A, et al.: Biomarkers in acutely decompensated heart failure with preserved or reduced ejection fraction. Am Heart J 2012; 164: 763–770 e3.
- Borlaug BA, Nishimura RA et al.: Exercise hemodynamics enhance diagnosis of early heart failure with preserved ejection fraction. Circ Heart Fail 2010; 3: 588–595.
- Iriarte M, Murga N, et al.: Classification of hypertensive cardiomyopathy. Eur Heart J 1993; 14 Suppl J: 95–101.
- Redfield MM, Jacobsen SJ et al.: Burden of systolic and diastolic ventricular dysfunction in the community: appreciating the scope of the heart failure epidemic. JAMA 2003; 289: 194–202.
- Franssen C, Paulus WJ: Normal resting pulmonary artery wedge pressure: a diagnostic trap for heart failure with preserved ejection fraction. Eur J Heart Fail 2015; 17: 132–134.
- Thenappan T, Prins KW, et al.: Pulmonary hypertension secondary to heart failure with preserved ejection fraction. Can J Cardiol 2015; 31: 430–439.
- Paulus WJ, Tschope C: A novel paradigm for heart failure with preserved ejection fraction: comorbidities drive myocardial dysfunction and remodeling through coronary microvascular endothelial inflammation. J Am Coll Cardiol 2013; 62: 263–271.
- Mohammed SF, Hussain S, et al.: Coronary microvascular rarefaction and myocardial fibrosis in heart failure with preserved ejection fraction. Circulation 2015; 131: 550–559.
- Gandhi SK, Powers JC, et al.: The pathogenesis of acute pulmonary edema associated with hypertension. N Engl J Med 2001; 344: 17–22.
- Adamopoulos C, Zannad F, et al.: Ejection fraction and blood pressure are important and interactive predictors of 4-week mortality in severe acute heart failure. Eur J Heart Fail 2007; 9: 935–941.
- Bhatia RS, Tu JV, et al.: Outcome of heart failure with preserved ejection fraction in a population-based study. N Engl J Med 2006; 355: 260–269.
- Fonarow GC, Adams KF, et al.: Risk stratification for in-hospital mortality in acutely decompensated heart failure: classification and regression tree analysis. JAMA 2005; 293: 572–580.
- Gheorghiade M, Abraham WT, et al.: Systolic blood pressure at admission, clinical characteristics, and outcomes in patients hospitalized with acute heart failure. JAMA 2006; 296: 2217–2226.
- Lee TT, Chen J, Cohen DJ, Tsao L: The association between blood pressure and mortality in patients with heart failure. Am Heart J 2006; 151: 76–83.
- Pulignano G, Del Sindaco D, et al.: Clinical features and outcomes of elderly outpatients with heart failure followed up in hospital cardiology units: data from a large nationwide cardiology database (IN-CHF Registry). Am Heart J 2002; 143: 45–55.
- Schrier RW, Abraham WT: Hormones and hemodynamics in heart failure. N Engl J Med 1999; 341: 577-585.
- Rouleau JL, Roecker EB, et al.: Influence of pretreatment systolic blood pressure on the effect of carvedilol in patients with severe chronic heart failure: the Carvedilol Prospective Randomized Cumulative Survival (COPERNICUS) study. J Am Coll Cardiol 2004; 43: 1423–1429.
- McAlister FA, Wiebe N, et al.: Meta-analysis: beta-blocker dose, heart rate reduction, and death in patients with heart failure. Ann Intern Med 2009; 150: 784–794.
- Swedberg K, Komajda M, et al.: Ivabradine and outcomes in chronic heart failure (SHIFT): a randomised placebo-controlled study. Lancet 2010; 376: 875–885.
- Rimoldi SF, Messerli FH, et al.: Selective Heart Rate Reduction With Ivabradine Increases Central Blood Pressure in Stable Coronary Artery Disease. Hypertension 2016; 67: 1205–1210.
- Bock JS, Gottlieb SS: Cardiorenal syndrome: new perspectives. Circulation 2010; 121: 2592–2600.
- Ronco C, Cicoira M, McCullough PA: Cardiorenal syndrome type 1: pathophysiological crosstalk leading to combined heart and kidney dysfunction in the setting of acutely decompensated heart failure. J Am Coll Cardiol 2012; 60: 1031–1042.
- Epstein M, Pitt BC: A propitious time for initiating clinical trials in patients with heart failure with reduced ejection fraction and an estimated glomerular filtration rate <30 mL/min with an mineralocorticoid receptor antagonist and a K+ binder: “the forbidden fruit”. Eur Heart J 2016; 37: 3130–3134.
- Pickering TG, Herman L, et al.: Recurrent pulmonary oedema in hypertension due to bilateral renal artery stenosis: treatment by angioplasty or surgical revascularisation. Lancet 1988; 2: 551–552.
- Rimoldi SF, Yuzefpolskaya M, et al.: Flash pulmonary edema. Prog Cardiovasc Dis 2009; 52: 249–259.
- Kotecha D, Manzano L, et al.: Effect of age and sex on efficacy and tolerability of beta blockers in patients with heart failure with reduced ejection fraction: individual patient data meta-analysis. BMJ 2016; 353: i1855.
- Bangalore S, Wild D, et al.: Beta-blockers for primary prevention of heart failure in patients with hypertension insights from a meta-analysis. J Am Coll Cardiol 2008; 52: 1062–1072.
- Chen N, Zhou M, et al.: Calcium channel blockers versus other classes of drugs for hypertension. Cochrane Database Syst Rev 2010: CD003654.
- Thomopoulos C, Parati G, Zanchetti A: Effects of blood pressure-lowering treatment. 6. Prevention of heart failure and new-onset heart failure – meta-analyses of randomized trials. J Hypertens 2016; 34: 373–384; discussion 84.
- Bangalore S, Fakheri R, et al.: Angiotensin-Converting Enzyme Inhibitors or Angiotensin Receptor Blockers in Patients Without Heart Failure? Insights From 254,301 Patients From Randomized Trials. Mayo Clin Proc 2016; 91: 51–60.
- Messerli FH, Bangalore S: Angiotensin Receptor Blockers Reduce Cardiovascular Events, Including the Risk of Myocardial Infarction. Circulation 2017; 135: 2085–2087.
- Bavishi C, Messerli FH, et al.: Role of neprilysin inhibitor combinations in hypertension: insights from hypertension and heart failure trials. Eur Heart J 2015; 36: 1967–1973.
- McMurray JJ, Packer M, et al.: Angiotensin-neprilysin inhibition versus enalapril in heart failure. N Engl J Med 2014; 371: 993–1004.
- SHEP Cooperative Research Group: Prevention of stroke by antihypertensive drug treatment in older persons with isolated systolic hypertension. Final results of the Systolic Hypertension in the Elderly Program (SHEP). JAMA 1991; 265: 3255–3264.
- Beckett NS, Peters R, et al.: Treatment of hypertension in patients 80 years of age or older. N Engl J Med 2008; 358: 1887–1898.
- Pfeffer MA, Pitt B, McKinlay SM: Spironolactone for heart failure with preserved ejection fraction. N Engl J Med 2014; 371: 181–182.
- Pfeffer MA, Claggett B, et al.: Regional variation in patients and outcomes in the Treatment of Preserved Cardiac Function Heart Failure With an Aldosterone Antagonist (TOPCAT) trial. Circulation 2015; 131: 34–42.
- de Denus S, O’Meara E, et al.: Spironolactone Metabolites in TOPCAT – New Insights into Regional Variation. N Engl J Med 2017; 376: 1690–1692.
- Redfield MM: Heart failure with Preserved Ejection Fraction. N Eng J Med 2016; 375: 1868–1877.
- Messerli FH, Rimoldi SF, Bangalore S: The Transition from Hypertension to Heart Failure: Contemporary Update. JACC Heart Fail 2017;5: 541–551.
CARDIOVASC 2017; 16(5): 30–35
Autoren
- Dr. med. Louis Hofstetter
- Prof. Dr. med. Franz H. Messerli
- Prof. Dr. med. Stefano F. Rimoldi
Publikation
- CARDIOVASC




Comments are closed.