Patienten mit einer chronisch-obstruktiven Lungenerkrankung (COPD) sind anfällig für pulmonale Infektionen, welche die Symptome (v.a. die der Dyspnoe) erheblich verstärken. Epidemiologische Daten sind allerdings kaum vorhanden.
Patienten mit einer chronisch-obstruktiven Lungenerkrankung (COPD) sind anfällig für pulmonale Infektionen, welche die Symptome, vor allem die der Dyspnoe, erheblich verstärken. Epidemiologische Daten zu einer solchen infektexazerbierten COPD (AECOPD) sind allerdings kaum vorhanden [1].
Die COPD (GOLD II–IV) hat eine Prävalenz (>40 Jahre) von ca. 5,9%. Diese Patientenpopulation erlebt jeweils zwischen 0,6–2,7 akute Exazerbationen pro Jahr [2]. Eine akute Verschlechterung der Respiration stellt für die COPD-Patienten ein erhebliches Mortalitätsrisiko dar, etwa 10% der Patienten mit einer AECOPD, welche stationär aufgenommen werden, versterben. Auslöser für eine AECOPD sind in der Mehrzahl der Fälle (ca. 60%) Infektionen, ca. hälftig virale und bakterielle. In ca. 30% der Fälle kann kein auslösender Faktor gefunden werden. Hierbei ist zu bedenken, dass inhalative Noxen wie Nikotin und Stickoxide eine Exazerbation triggern können.
Eine akute respiratorische Verschlechterung kann natürlich auch durch andere Faktoren ausgelöst werden, sodass die Differenzialdiagnosen neben der akuten Pneumonie auch eine Herzinsuffizienz, Pneumothorax, Pleuraerguss, Lungenemboli oder neu aufgetretene Arrhythmien umfassen können [3]. In einer Studie mit 1016 Patienten waren die Gründe für eine stationäre Einweisung bei Verdacht auf eine AECOPD 48% Atemwegsinfektionen, 26% Herzinsuffizienz, 3% Bronchial-Karzinom, 1% Lungenembolie, und 1% Pneumothorax [4]. Die therapeutischen Möglichkeiten während einer AECOPD sind aktuell nicht standardisiert und teilweise nur eingeschränkt effektiv. Daher ist die Prävention einer Exazerbation von grosser Bedeutung.
COPD-Patienten mit wiederholten Exazerbationen haben eine verringerte Lebensqualität und Lebenserwartung (ca. 10% der hospitalisierten AECOPD-Patienten versterben). Eine Prävention einer Exazerbation kann z.B. mittels oralen Mykolytika und Bronchodilatatoren erreicht werden. Interessant in diesem Zusammenhang ist, dass zwar die Schwere einer Exazerbation reduziert wird, nicht aber die Mortalität [5]. Im Folgenden werden die Möglichkeiten der Bildgebung bei einer AECOPD besprochen. Ein Schwerpunkt soll aber auf der diagnostischen Risikoabschätzung einer AECOPD bei Patienten mit COPD liegen.
Bildgebung
Vor allem Patienten mit einer COPD können nicht lange die Luft anhalten und schlecht flach auf dem Rücken liegen. Um dennoch «scharfe» Aufnahmen des Thorax zu erhalten, muss die Aufnahme also möglichst schnell erfolgen. Diese Anforderungen erfüllen zwei Untersuchungsmodalitäten: das Röntgen und die Computertomografie (CT). Im Rahmen der PROVIDI-Studie wurden die Möglichkeiten der CT zur Vorhersage einer AECOPD eingehend untersucht [6].
Röntgen Thorax
Zur initialen radiologischen Untersuchung eines Patienten mit einer AECODP steht das Röntgen des Thorax, wenn möglich im Stehen in 2 Ebenen [2]. Hiermit können differenzialdiagnostische Erkrankungen wie Pneumonie, Pneumothorax, Pleuraerguss oder Herzinsuffizienz ausgeschlossen werden. Bei ca. einem Fünftel der vermeintlichen AECOPD-Patienten ändert sich die Diagnose, vor allem wegen einer Pneumonie, und entsprechend die Therapie [3,7–9].
Im Röntgen des Thorax bei Patienten mit COPD zeigen sich charakteristische Veränderungen im Vergleich zum Gesunden. Vor allem die ausgeprägte Überblähung ist offensichtlich, mit tief stehenden Zwerchfellen, einer Vergrösserung des Retrosternalraumes und Vergrösserung der interkostalen Abstände. Die Herzsilhouette ist in der Regel eher schmal und es zeigt sich eine rarefizierte Pulmonalgefässzeichnung. Im Rahmen einer Infektexazerbation zeigt sich oftmals eine Verdickung der Bronchialwände, welche zu einer deutlich reduzierten Belüftung der peripher gelegenen Lungenabschnitte führt (Abb. 1).
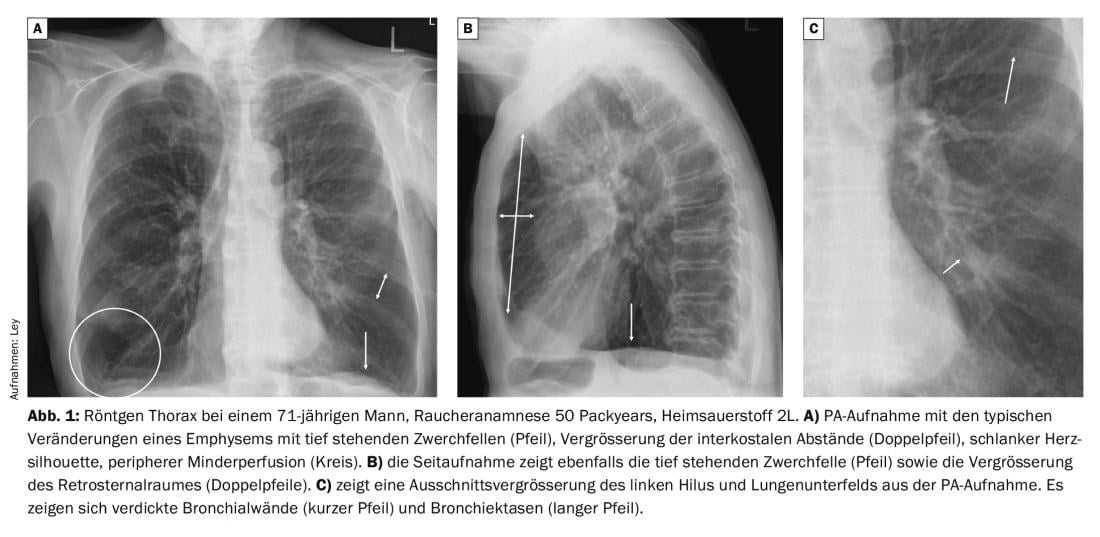
Wie oben bereits ausgeführt, zeigen sich bei ca. 20% der Patienten relevante Befunde wie z.B. Pneumonien. Im Fall einer typischen, bakteriellen Infektion sieht man eine flächige Verdichtung eines Segments, Lappens oder der ganzen Lunge (Abb. 2).

Eine aktuelle Studie an nicht-hospitalisierten AECOPD-Patienten zeigte in 20% der Fälle ein Infiltrat [10]. Erreger wurden zahlreiche identifiziert, z.B. Haemophilus und Streptococcus. Interessanterweise ergaben sich in der pulmonalen Besiedlung keine Unterschiede zwischen COPD-Patienten mit Exazerbation und solchen ohne. Zum anderen zeigten sich Pneumonien gehäuft in den Wintermonaten. Daher wurde geschlussfolgert, dass Exazerbationen und Pneumonien bei COPD-Patienten gemeinsame infektiöse Trigger haben und eher ein Kontinuum darstellen als separate Entitäten.
Computertomografie (CT)
Eine CT des Thorax mit Fokus auf dem Lungenparenchym kann ohne intravenöse Kontrastmittelgabe erfolgen. Eine Aufnahme in Atemstillstand ist wünschenswert, kann aber von Patienten mit einer AECOPD nicht immer realisiert werden. Teilweise ist eine flache Rückenlage auf dem CT-Untersuchungstisch kaum möglich, dann noch für 4–10 Sekunden (je nach CT-Gerät) Luft anhalten ist ebenfalls eine enorme Herausforderung für die Patienten. Wenn es um den Ausschluss einer Lungenarterienembolie geht, ist eine i.v. KM-Gabe unverzichtbar. Als Schichtdicke haben sich für beide Fragestellungen 1-mm-Schichten etabliert.
Die phänotypischen Veränderungen einer COPD lassen sich in einen Emphysem-Phänotyp und einen Atemwegsphänotyp klassifizieren [11]. Von einer bronchialen Dilatation spricht man, wenn das Lumen des Bronchus 110–150% des Lumens der begleitenden Pulmonalarterie beträgt. Bei mehr als 150% spricht man von einer Ektasie. Zusätzlich findet man bei Bronchiektasen eine fehlende Verjüngung in die Peripherie. Bronchiektasen können zylindrisch, varikös und zystisch konfiguriert sein.
Die bronchiale Wand wird im Verhältnis Innen- zu Aussendurchmesser beurteilt: Wenn das Verhältnis 0,5–0,8 beträgt, spricht man von einer milden Wandverdickung, <0,5 bezeichnet eine schwere Wandverdickung. Zusätzlich findet man bei COPD-Patienten mit Raucheranamnese häufig Bronchien, welche durch Mukus verlegt sind.
Vor allem Patienten mit einem Atemwegstyp scheinen besonders anfällig für eine AECOPD. Mittels CT konnte gezeigt werden, dass eine bronchiale Wandverdickung im Rahmen einer AECOPD signifikant häufiger auftrat als im «normalen» Intervall (Abb. 3) [12]. Allerdings ist die Interreader-Übereinstimmung für die Beurteilung der Bronchialwandverdickung schlecht.

Wie initial bereits erwähnt, ist die Vermeidung einer Exazerbation ein wichtiges Ziel. Hierfür müssen Patienten mit einer erhöhten Suszeptibilität für eine Exazerbation identifiziert werden. Im Rahmen der COPD-Gene-Studie wurden 833 Patienten identifiziert, welche 0–1 Exazerbationen hatten und 169 Patienten mit mehr als 2 Exazerbationen [13]. Dabei zeigte sich, dass mit jedem mm Zunahme der bronchialen Wanddicke auf Segmentebene die jährliche Exazerbationsrate um den Faktor 1,84 anstieg. Patienten mit mehr als 35% Lungenemphysem zeigten pro 5% Zunahme des Emphysems eine Zunahme der Exazerbationsrate um das 1,18-Fache. Diese Daten lassen eine routinemässige Phänotypisierung von Patienten mit COPD mittels CT für sinnvoll scheinen.
Neben der Wanddicke ist auch die bronchiale Dilatation von grosser Relevanz für eine Exazerbation. Bronchiektasen erhöhten das Risiko für eine Exazerbation signifikant (Odds Ratio 4,99) und waren unter verschiedenen Parametern der stärkste Prädiktor (Abb. 4) [14]. Der Nachweis bzw. Kenntnis von Bronchiektasen hat auch klare therapeutische Relevanz, da z.B. eine i.v. Antibiose auf P. aeroginosa bei vorhandenen Bronchiektasen indiziert sein kann [1]. Die Keimbesiedlung in solchen Bronchiektasen bei Exazerbation lässt oftmals atypische Erreger vermuten, vor allem Mykobakterien. Hier konnte gezeigt werden, dass Mykobakterien bei Patienten mit seltenen COPD-Exazerbationen häufiger nachzuweisen waren als bei Patienten mit häufigen Exazerbationen [14].

Neben den peripheren Atemwegen spielen auch die zentralen Atemwege, Trachea und Hauptbronchien, eine wichtige Rolle bei der Atemstromlimitation. Patienten mit COPD erzeugen einen erheblichen Unterdruck in Trachea und Hauptbronchien bei der Inspiration. Zwei Faktoren führen (einzeln oder zusammen) zu einem exspiratorischen zentralen Atemwegskollaps (ECAC: expiratory central airway collaps) [15].
Im Laufe der Zeit kann es zu einer Aufweichung der Knorpelspangen kommen, was in eine Malazie mündet. Eine solche Tracheobronchomalazie hat eine Prävalenz von 5–10% bei COPD Patienten [16]. Zudem kommt es zu einer vermehrten Einwölbung der Pars membranacea. Wenn diese zu einer Lumenreduktion um >50% führt, spricht man von einem «exzessiven dynamischen Atemwegskollaps» (EDAC: excessive dynamic airway collapse) (Abb. 5).

Dass Patienten mit COPD einen signifikant höheren Atemwegskollaps zeigen als normale Patienten, ist bekannt. Allerdings spielt dies bei der Genese einer Exazerbation keine relevante Rolle, da sich die Atemwegsinstabilität zwischen stabilen und exazerbierten COPD nicht unterscheiden [15].
Es scheint allerdings auch ein Zusammenhang zwischen der Schwere des Lungenemphysems und Exazerbationen zu bestehen [17]. Die Patienten rekrutierten sich aus einer Lungenkarzinom-Screening-Population. Es wurde der COPD-Phänotyp Emphysem- oder nicht-Emphysemtyp bestimmt. Die Emphysem-Phänotyp-Patienten waren deutlich schwerer erkrankt (vorhergesagter FEV1: 61% vs. 90%) als die nicht-Emphysem-COPD-Patienten. Daher ist es nicht wirklich verwunderlich, dass in der Gruppe der schwerer erkrankten Patienten sich häufiger Exazerbationen zeigten als in der fast gesunden Population.
Ein übergreifender Effekt ist die Ventilation einzelner Lungenregionen. Mittels hyperpolarisiertem Helium kann in der Magnet-Resonanztomografie (MRT) die regionale Ventilation dargestellt werden. Bei Patienten mit COPD werden regelhaft Ventilationsdefekte gefunden. Bei Patienten mit milder bis mittelschwerer COPD war das Ausmass der Ventilationsdefekte korreliert mit der Anzahl der Exazerbationen [18]. Die Ventilationsdefekte korrelierten wiederum mit dem Ausmass der Parenchymdestruktion (Emphysem) und der Atemwegserkrankung – also einem gemischten COPD-Phänotyp. Da man Ventilations-MRT-Untersuchungen nur in einzelnen Zentren weltweit durchführen kann und die Beurteilung des Lungenparenchyms/Atemwege nur eingeschränkt möglich ist, wurden mittels CT Ventilationskarten erstellt. Hierzu wurden Inspirations- und Exspirations-CT-Datensätze aus der COPD-Gene-Kohorte untersucht [19]. Mithilfe einer nicht-rigiden Registrierung wurden die Daten übereinandergelegt. Somit konnten regionale Deformationskarten erstellt werden. Erstaunlicherweise wiesen Patienten mit vermehrten Exazerbationen (≥6/Jahr) eine homogenere Ventilation auf als Patienten mit keinen Exazerbationen.
CT-Datensätze bieten aufgrund der hohen räumlichen Auflösung auch die Möglichkeit der Segmentierung von anatomischen Strukturen, z.B. den Atemwegen. Diese segmentierten Daten können dann z.B. für eine Simulation der Atemströme und der regionalen Widerstände genutzt werden. 42 COPD-Patienten wurden während einer Exazerbation und 6–8 Wochen im Verlauf mittels CT untersucht [20]. Die Atemwege wurden aus den CT-Daten segmentiert und für eine Simulation der Atemwegsströme genutzt. Hierbei zeigte sich, dass während einer Exazerbation es zu einer deutlichen Zunahme des zentralen und peripheren Atemwegswiderstandes kommt. Interessant war, dass vor allem die Abnahme des peripheren Atemwegswiderstandes mit der funktionellen Erholung assoziiert war. Daher scheint eine übermässige Entzündung der peripheren Atemwege ein entscheidender Faktor bei der Entstehung einer Exazerbation zu sein (es wurden Atemwege der 4.–8. bronchialen Generation untersucht). D.h. diese Regionen müssen therapeutisch erreicht werden, da allerdings die Atemströme signifikant während einer Exazerbation verändert sind, müssen orale Medikamente oder inhalative Substanzen mit extra-kleinem Durchmesser verabreicht werden.
Exkurs Pulmonale Hypertonie
Es ist bekannt, dass eine COPD nicht nur die kleinen Atemwege und Alveolen betrifft, sondern auch die kleinen Pulmonalarterien (Durchmesser <500 µm). Diese vaskulären Veränderungen werden auch in Patienten mit moderater COPD und bei Rauchern mit normaler Lungenfunktion gefunden. Daher ist davon auszugehen, dass eine Vaskulopathie bereits in frühen Stadien einer raucherassoziierten Atemwegserkrankung auftritt. Ca. 4% der Patienten mit COPD haben eine pulmonale Hypertonie (PH), die PH-COPD ist in der Gruppe 3 der WHO-Klassifikation der PH gelistet [21]. In einer grossen Studie mit über 54.000 Teilnehmern war eine PH-COPD ein signifikanter Risikofaktor für eine stationäre AECOPD-Behandlung und -Mortalität. In einer echokardiografischen Studie konnte andererseits der Effekt einer Exazerbation auf die Rechtsherzfunktion gezeigt werden: Während der Exazerbation betrug der abgeschätzte PASP 40 mmHg und nach Rekonvaleszenz 29 mmHg [22]. Allerdings ist die Echokardiografie bei COPD-Patienten teilweise schwierig in der Beurteilung des PASP, der Referenzstandard, der invasive Rechtsherzkatheter, kann nicht bei allen COPD-Patienten durchgeführt werden. Auch hier hilft die CT mit einer einfachen Messung weiter: Ein Verhältnis Durchmesser der Pulmonalarterie zu Aorta ascendens >1:1 war deutlich mit dem Auftreten einer AECOPD assoziiert (Odds Ratio 4,78) (Abb. 6) [23]. Konkret hatten Patienten der COPD-Gene-Studie mit PA:A-Verhältnis >1 in 53% der Fälle eine Exazerbation. Die Durchmesser-Bestimmung der Pulmonalarterie kann auf axialen Schichten erfolgen, kurz vor der Bifurkation [24].

Take-Home-Messages
- Bei Verdacht auf eine exazerbierte COPD ist die Röntgenuntersuchung des Thorax eine wichtige Methode, um Differenzialdiagnosen zu erkennen.
- Eine Statuserhebung und Charakterisierung von COPD mittels Computertomografie ist eine sinnvolle Untersuchung, um das individuelle Risiko einer Exazerbation zu bestimmen.
- Vor allem Patienten mit einem Atemwegs-Phänotyp der COPD (Wandverdickung und bronchialer Dilatation) sind anfällig für eine Exazerbation.
Literatur:
- Hoffken G, Lorenz J, Kern W, et al: (2005) [S3-guideline on ambulant acquired pneumonia and deep airway infections]. Pneumologie 59: 612–664.
- Lange CG, Scheuerer B, Zabel P: (2004) [Acute exacerbation of COPD]. Internist (Berl) 45: 527–538.
- McCrory DC, Brown C, Gelfand SE, Bach PB: (2001) Management of acute exacerbations of COPD: a summary and appraisal of published evidence. Chest 119: 1190–1209.
- Connors AF, Jr., Dawson NV, Thomas C, et al.: (1996) Outcomes following acute exacerbation of severe chronic obstructive lung disease. The SUPPORT investigators Study to Understand Prognoses and Preferences for Outcomes and Risks of Treatments). Am J Respir Crit Care Med 154: 959–967
- Wedzicha JA, Calverley PMA, Albert RK, et al.: (2017) Prevention of COPD exacerbations: a European Respiratory Society/American Thoracic Society guideline. Eur Respir J 50.
- Jairam PM, van der Graaf Y, Lammers JW, et al.: (2015) Incidental findings on chest CT imaging are associated with increased COPD exacerbations and mortality. Thorax 70: 725–731.
- Emerman CL, Cydulka RK: (1993) Evaluation of high-yield criteria for chest radiography in acute exacerbation of chronic obstructive pulmonary disease. Ann Emerg Med 22: 680–684
- Snow V, Lascher S, Mottur-Pilson C: (2001) The evidence base for management of acute exacerbations of COPD: clinical practice guideline, part 1. Chest 119: 1185–1189.
- Soto FJ, Varkey B: (2003) Evidence-based approach to acute exacerbations of COPD. Curr Opin Pulm Med 9:117-124
- Williams NP, Ostridge K, Devaster JM, et al.: (2018) Impact of radiologically stratified exacerbations: insights into pneumonia aetiology in COPD. Respir Res 19: 143.
- Lynch DA, Austin JH, Hogg JC et al (2015) CT-Definable Subtypes of Chronic Obstructive Pulmonary Disease: A Statement of the Fleischner Society. Radiology. 10.1148/radiol.2015141579:141579
- Hackx M, Ghaye B, Coche E, et al.: (2015) Severe COPD exacerbation: CT features. Copd 12: 38–45.
- Han MK, Kazerooni EA, Lynch DA, et al.: (2011) Chronic obstructive pulmonary disease exacerbations in the COPDGene study: associated radiologic phenotypes. Radiology 261: 274–282.
- Kawamatawong T, Onnipa J, Suwatanapongched T (2018) Relationship between the presence of bronchiectasis and acute exacerbation in Thai COPD patients. Int J Chron Obstruct Pulmon Dis 13: 761–769
- Leong P, Tran A, Rangaswamy J, et al.: (2017) Expiratory central airway collapse in stable COPD and during exacerbations. Respir Res 18:163
- Patel R, Irugulapati L, Patel V, et al.: (2009) The Prevalence of Tracheobronchomalacia in Patients with Asthma or Chronic Obstructive Pulmonary Disease. The Internet Journal of Pulmonary Medicine 12: 1–5.
- Barros MC, Hochhegger B, Altmayer S, et al.: (2018) Quantitative computed tomography phenotypes, spirometric parameters, and episodes of exacerbation in heavy smokers: An analysis from South America. PLoS One 13: e0205273.
- Kirby M, Pike D, Coxson HO, et al.: (2014) Hyperpolarized (3)He ventilation defects used to predict pulmonary exacerbations in mild to moderate chronic obstructive pulmonary disease. Radiology 273: 887–896.
- Bragman FJ, McClelland JR, Modat M, et al.: (2014) Multi-scale analysis of imaging features and its use in the study of COPD exacerbation susceptible phenotypes. Med Image Comput Comput Assist Interv 17: 417–424.
- Hajian B, De Backer J, Vos W, et al.: (2018) Changes in ventilation-perfusion during and after an COPD exacerbation: an assessment using fluid dynamic modeling. Int J Chron Obstruct Pulmon Dis 13: 833–842.
- Medrek SK, Sharafkhaneh A, Spiegelman AM, et al.: (2017) Admission for COPD Exacerbation Is Associated with the Clinical Diagnosis of Pulmonary Hypertension: Results from a Retrospective Longitudinal Study of a Veteran Population. Copd 14: 484–489.
- Ozben B, Eryuksel E, Tanrikulu AM, et al.: (2015) Acute Exacerbation Impairs Right Ventricular Function in COPD Patients. Hellenic J Cardiol 56: 324–331.
- Wells JM, Washko GR, Han MK, et al.: (2012) Pulmonary arterial enlargement and acute exacerbations of COPD. N Engl J Med 367: 913–921.
- Rho JY, Lynch DA, Suh YJ, et al.: (2018) CT measurements of central pulmonary vasculature as predictors of severe exacerbation in COPD. Medicine (Baltimore) 97: e9542.
- Vogelmeier C, Buhl R, Burghuber O, et al.: (2018) S2k-Leitlinie zur Diagnostik und Therapie von Patienten mit chronisch obstruktiver Bronchitis und Lungenemphysem (COPD). AWMF online.
InFo PNEUMOLOGIE & ALLERGOLOGIE 2019; 1(2): 10–14
Autoren
- Prof. Dr. med. Sebastian Ley
Publikation
- INFO PNEUMOLOGIE & ALLERGOLOGIE


Comments are closed.