Um die 200’000 Patienten in der Schweiz leben mit der Diagnose Herzinsuffizienz. Bis zu 10% von ihnen entwickeln progrediente Symptome. Ab wann spricht man von einer schweren Herzinsuffizienz und was kann man dann machen?
In 2018 publizierte die Heart Failure Association of the European Society of Cardiology ein Positionspaper mit dem Thema der schweren Herzinsuffizienz [1]. Dieser Text ist grösstenteils eine Zusammenfassung, der dort publizierten Empfehlungen.
In der Schweiz leben 150’000–200’000 Patienten mit der Diagnose Herzinsuffizienz [2]. Trotz Fortschritte in der Herzinsuffizienztherapie in den letzten Jahren und neuen Medikamenten, wie beispielsweise Sacubitril/Valsartan, werden ca. 5–10% der Patienten mit Herzinsuffizienz progrediente Symptome entwickeln und an einer fortschreitenden, schweren Herzinsuffizienz leiden [3–5]. Die Anzahl der Patienten mit schwerer Herzinsuffizienz wird bei verbessertem Überleben und steigender Inzidenz der Herzinsuffizienz weiter zunehmen. Es ist entscheidend, dass Grundversorger und niedergelassene Kardiologen die schwere Herzinsuffizienz erkennen und diagnostizieren und die Patienten zum richtigen Zeitpunkt weiter an ein tertiäres Herzinsuffizienzzentrum überweisen. Nur so können weitere Therapiemöglichkeiten, inklusive die Listung zur Herztransplantation oder der Einsatz von mechanischen Kreislaufunterstützungssystemen (MCS) frühzeitig geplant und erfolgreich umgesetzt werden.
Definition der schweren Herzinsuffizienz und Prognosebestimmung
In der Literatur gibt es verschiedene Definitionen der schweren Herzinsuffizienz [5–8]. Aufgrund ihrer Vollständigkeit und klinischen Anwendbarkeit erachten wir die kürzlich publizierte Definition der Heart Failure Associaton (HFA)-ESC als für den klinischen Alltag sehr nützlich. Dabei müssen alle der folgenden Kriterien trotz optimaler Herzinsuffizienztherapie erfüllt sein
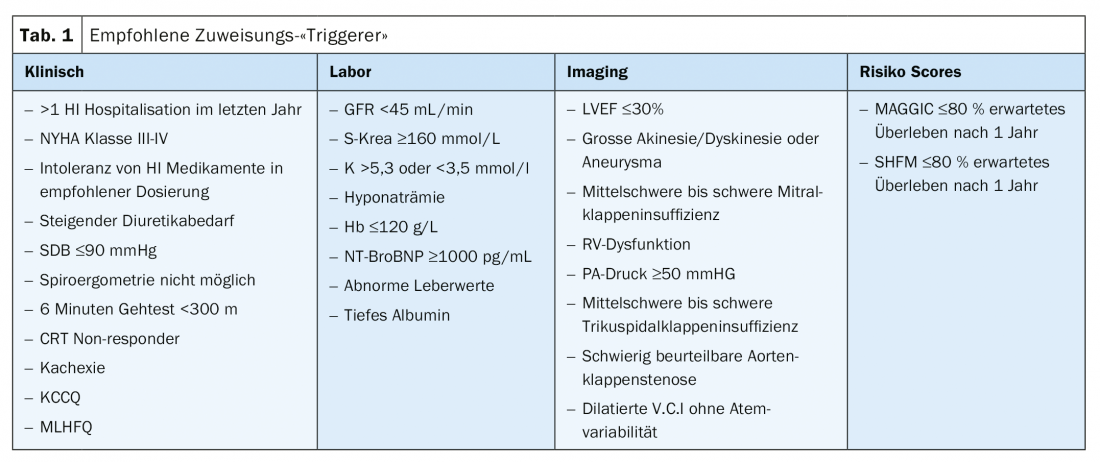
- Schwere persistierende Symptome der Herzinsuffizienz (NYHA Klasse III oder IV)
- Schwere kardiale Dysfunktion, definiert durch eine Reduktion der LVEF <30%, isoliertes rechtsventrikuläres Versagen oder nicht operable schwere Klappenabnormitäten oder kongenitale Abnormitäten oder persistierend hohe (alternativ steigende) BNP/NT-proBNP Werte und schwere diastolische Dysfunktion oder strukturelle LV Abnormitäten entsprechend der ESC Definition von HFpEF und HFmrEF
- Episoden von Lungenstauung oder systemischer Stauung, welche eine hoch dosierte intravenöse Therapie mit Diuretika (oder Diuretikakombinationen) erfordert oder Episoden von low-output mit Bedarf an Inotropika oder vasoaktive Medikamente oder maligne Arrhythmien, welche zu mindestens einer ungeplanten Vorstellung oder Hospitalisation in den letzten 12 Monaten geführt hat
- Schwere Einschränkung der körperlichen Leistungsfähigkeit, optimalerweise objektiviert durch einen 6-Minuten-Gehtest unter 300 Meter oder eine Spiroergometrie mit maximaler O2-Aufnahme von (pVO2 <12–14 mL/kg/min) mit vermuteter kardialer Genese
Zusätzlich ist die fortgeschrittene Herzinsuffizienz durch systemische Organdysfunktionen (Niereninsuffizienz, kardiale Kachexie, Leberinsuffizienz) und/oder pulmonale Hypertonie gekennzeichnet. In diesem Sinne sind ein kardio-renales Syndrom oder eine Gewichtsabnahme von 6% des Körpergewichts innerhalb von 6 Monaten (Definition kardiale Kachexie) als Indikatoren einer schweren Herzinsuffizienz zu werten. Eine kardial bedingte pulmonale Hypertonie sollte frühzeitig dokumentiert und als Hinweis für eine fortgeschrittene Herzinsuffizienz gewertet werden. Wird diese zu spät erkannt, besteht das Risiko, dass ihr Ausmass eine Kontraindikation zur Herztransplantation darstellt. Auch kann die damit verbundene Verschlechterung der Rechtsherzfunktion eine weiterführende Therapie mit einem linksventriulären Herzunterstützungssystem (Left Ventricular Assist Device) verunmöglichen.
Begleiterkrankungen sind sehr häufig mit Herzinsuffizienz vergesellschaftet. Bei der Definition der schweren Herzinsuffizienz ist Kriterium 1 und 4 auch dann als erfüllt anzusehen, wenn eine kardiale Dysfunktion nach Kriterium 2 besteht, aber ein Grossteil der Limitierung durch eine Komorbidität (z.B. pulmonale Erkrankung) erklärt ist. Komorbiditäten wie beispielsweise Diabetes, Lungenerkrankungen (COPD, Schlafapnoe), Niereninsuffizienz, Anämie, Eisenmangel oder chronisch rheumatische Erkrankungen beeinflussen die Prognose einer Herzinsuffizienz erheblich und sollten bestmöglich behandelt werden [9]. Komorbiditäten sollten deshalb unbedingt in die Gesamtbeurteilung und Prognostizierung einfliessen, da sie einerseits den Schweregrad der Herzinsuffizienz wiederspiegeln können und andererseits auch als mögliche Kontraindikationen für Herzersatztherapien (Herztransplantation, Herzunterstützungssysteme) in Frage kommen. Besonders eine Endorgandysfunktion hat einen negativen Einfluss auf die Gesamtprognose. Weitere Abklärungen um eine mögliche Reversibilität einer Endorgandysfunktion nach der Transplantation oder einer mechanischen Herzunterstützung vorherzusagen (bsp. bei Niereninsuffizienz) sind sinnvoll, bleiben aber oft unschlüssig.
Eine regelmässige Risikostratifizierung ist bei schwerer Herzinsuffizienz zentral um den optimalen Zeitpunkt für eine Zuweisung ins Herzinsuffizienzzentrum nicht zu verpassen und weiterführende Abklärungen, Behandlungen und Nachkontrollen einzuleiten. Die Vorhersage der Prognose und die damit verbundene Risikostratifizierung kann nicht anhand eines einzelnen Parameters vorgenommen werden, sondern erfordert den Einbezug von unterschiedlichen, prognose-sensitiven Variablen. Verschiedene solche multivariablen Scores wurden klinisch validiert und finden breite Anwendung. Der Heart Failure Survival Score (HFSS) und das Seattle Heart Failure Model (SHFM) zählen zu den im klinischen Alltag am häufigsten verwendeten Scores [10,11]. Weitere Scores sind der (MECKI) score (Metabolic Exercise test data combinded with Cardiac and Kidney indexes score) und der MAGGIC Score Meta-Analysis Global Group in Chronic Herat Failure [12–15].
Obwohl das Erreichen eines bestimmten Scores (bsp. HFSS) mit einer Empfehlung zur Evaluation einer Herzersatztherapie verbunden ist, gibt es derzeit keinen Grenzwert, ab welchem eine Zuweisung ins Herzinsuffizienzzentrum erfolgen sollte. In Tabelle 1 sind die vom HFA-ESC gelisteten klinischen, laborchemischen-, Imaging- und Risiko-Score Triggers zusammengestellt, welche zur Zuweisung in ein Herzinsuffizienzzentrum führen sollten. Allzu oft werden Patienten leider zu spät überwiesen. Allgemein gilt: Ist die Definition der schweren Herzinsuffizienz erfüllt, sollte Kontakt mit einem Zentrum aufgenommmen werden.
Spiroergometrie und 6-Minuten Gehtest
Die Spiroergometrie ist eine zentrale Untersuchung zur Risikostratifizierung ambulanter Patienten mit Herzinsuffizienz. Zusätzlich zu prognostischen Informationen, werden objektive Daten zur globalen Leistungsfähigkeit, zur kardio-pulmonalen Limitierung und kardiovaskulären Reserve generiert.
Eine maximale Sauerstoffaufnahme (pVO2) ≤12 ml/kg/min (≤14 ml/kg/min ohne Betablockertherapie) gilt als Indikation für eine Listung für eine Herztransplantation oder MCS nach den Guidelines [16]. Frauen, welche ≤50% der maximalen Sauerstoffaufnahme erreichen, könnten falls sie jünger als 50 Jahre sind ebenfalls für eine Herztransplantation evaluiert werden [16]. Falls das Atemäquivalent für Kohlendioxid (V E/V CO2) mehr als 35 beträgt, ist dies ein Hinweis auf eine schlechte Prognose.
Der 6-Minuten-Gehtest ist im Gegensatz zur Spiroergometrie, welche ein maximaler Belastungstest darstellt, ein submaximaler Belastungstest. Die Resultate der Studien bezüglich Korrelation mit dem Überleben sind nicht übereinstimmend [17–20]. Falls eine Spiroergometrie nicht möglich ist, ist der 6-Minuten-Gehtest eine valide Alternative. Eine Gehstrecke von <300 Metern identifiziert dabei Patienten mit schwerer Leistungsintoleranz.
Behandlungsstrategien für Patienten mit schwerer Herzinsuffizienz
Es gibt nur zwei Langzeit-Behandlungsstrategien bei der schweren Herzinsuffizienz, falls man sich nicht für ein palliatives Konzept entscheidet. Diese sind die Herztransplantation oder ein mechanisches Kreislaufunterstützungssystem (MCS). Als überbrückende Lösungen stehen mechanische Kurzeit-Kreislaufunterstützungssysteme und intravenöse vasoaktive Medikamente zur Verfügung. Die Basistherapie der Überwässerung sind Diuretika.
Behandlung der Überwässerung
Schleifendiuretika bilden die Basistherapie der Hypervolämie. Bei schwerer Herzinsuffizienz bestehen oft eine Diuretika-Resistenz und zunehmende Niereninsuffizienz. Die Langzeitanwendung von Diuretika kann zu verschiedenen renalen Adaptationsmechanismen, wie zum Beispiel Hypertrophie und Hyperfunktion im Bereich des distalen Nephrons, sowie einer vermehrten Reninsekretion führen. Zusätzlich können eine Zunahme der urämischen Anionen und eine Proteinurie die Wirksamkeit der Diuretika beeinträchtigen [21]. Im klinischen Alltag wird oft eine sequentielle Nephronblockade, eine Kombination aus Schleifendiuretikum und einem Thiaziddiuretikum (bsp. Metolazone), eingesetzt um die Diuretikaresistenz zu durchbrechen. Für dieses Vorgehen gibt es allerdings wenig Evidenz.
Mit der sog. Ultrafiltration kann Flüssigkeit vom Blut durch eine semipermeable Membran über ein Dialysegerät entfernt werden. Bei fehlendem Ansprechen auf perorale Diuretika ist primär eine Umstellung auf eine intravenöse Gabe empfohlen. Dabei soll mit einer höheren Dosierung begonnen und diese sukzessive gesteigert werden, bis eine suffiziente Diurese erreicht ist. Wird diese nicht erreicht, wird als nächster Schritt eine Diuretikakombination mit sequentieller Nephronblockade empfohlen und nur falls ebenfalls diese Massnahmen versagen sollte in ausgewählten Fällen eine Ultrafiltration in Betracht gezogen werden [7,9].
Intravenöse vasoaktive Medikamente
Diese spielen vor allem in der akuten Situation bei Patienten mit Hinweis für ein Low Output Syndrom und Hypoperfusion eine Rolle. Zusätzlich besteht eine Indikation bei ausgewählten Patienten als Überbrückung bis zur Implantation von einem MCS oder Durchführung einer Herztransplantation. Obwohl Inotropika die hämodynamischen Parameter verbessern können, zeigen die Studien überwiegend keine Verbesserung des Outcomes. Einige Studien weisen sogar auf eine Verschlechterung der Prognose hin [22–24]. Deshalb ist eine Langzeitanwendung von Inotropika zu vermeiden. Einzig, falls keine anderen Therapieoptionen in Frage kommen, kann in ausgewählten Fällen eine sequentielle Therapie mit Inotropika als palliative Massnahme eingesetzt werden [25,26].
Mechanische Kreislaufunterstüzungssysteme: Kurzzeitsysteme
Mechanische Kurzzeit-Kreislaufunterstützungssysteme kommen in der akuten Phase eines kardiogenen Schocks zum Einsatz. Sie ermöglichen ein Zeitfenster während dem sich die kardiale Funktion durch maximale Entlastung erholen kann. Zusätzlich kann man auch den Verlauf der Erholung anderer Organsysteme, wie beispielsweise die neurologische Funktion nach einem Herzkreislaufstillstand abwarten. Kommt es jedoch zu keiner Verbesserung der kardialen Funktion können Kurzzeitsysteme «eine Brücke» zur Implantation einer langfristigen Herzkreislaufunterstützung (Ventricular Assist Device, VAD) oder einer Herztransplantation darstellen, falls man sich für diese Option entscheiden sollte. Es gibt verschiedene mechanische Kreislaufunterstützungssysteme, welche für eine begrenzte Zeit angewendet werden können. Die intra-aortale Ballonpumpe (IABP) wird mittels Katheter perkutan implantiert. Ein Ballon wird in der deszendierenden Aorta implantiert und jeweils während der Diastole inflatiert. Dadurch wird der Druck in der Aortenwurzel diastolisch erhöht, was zu einer verbesserten Koronarperfusion führt. Die Deflation des Ballons führt zu einer Reduktion der Nachlast und vermindert somit den Sauerstoffverbrauch. Aktuell wird die IABP vor allem beim kardiogenen Schock bei ischämischer Herzkrankheit von einigen Zentren eingesetzt, obwohl die Evidenz für eine Verbesserung der Mortalität nicht gezeigt werden konnte [1,27].
Eine Impella ist eine axiale intravaskuläre Pumpe, welche ebenfalls mittels Katheter implantiert werden kann. Sie kann bis zu 5 Liter Blut pro Minute vom linken Ventrikel in die Aorta ascendens transportieren und entlastet so den linken Ventrikel. Die Hämodynamik wird verbessert und der Füllungsdruck gesenkt; gleichzeitig wird der koronare Perfusionsdruck erhöht.
Obwohl bis jetzt keine eindeutigen Daten bezüglich einer Verbesserung der Mortalität erhoben werden konnten, zeigte eine kleine Registerstudie, dass das Benutzen von einem standardisierten Protokoll mit frühem hämodynamischen Support mittels Impella CP bei kardiogenem Schock möglicherweise mit einem verbesserten Outcome und tieferer Mortalität assoziiert ist [28].
Bei der extracorporalen Membranoxygenierung (ECMO) wird das Blut durch eine Membran in einer speziellen Herz-Lungen-Maschine ausserhalb des Körpers oxygeniert. Zusätzlich zum kompletten respiratorischen Support, enthält das ECMO Gerät eine axiale Pumpe, sodass Flüsse bis 6 L/min erreicht werden können. Eine periphere venös-arterielle ECMO kann durch einen interventionellen Kardiologen mittels Seldinger Technik implantiert werden und die Zirkulation bei versagendem Herzen aufrechterhalten sowie die Oxygenierung unterstützen.
Die hämodynamischen Effekte einer ECMO sind nicht physiologisch. Zum einen wird die Vorlast des Herzens reduziert indem das Blut von der venösen Seite drainiert wird. Andererseits führt der Auswurf des oxygenierten Blutes mit einem Fluss von 4–6 L/min in die Aorta zu einem Anstieg der Nachlast des linken Ventrikels, was je nach kardialer Dysfunktion zu einer Zunahme des enddiastolischen linksventrikulären Volumens und des Füllungsdrucks führen kann. Um in dieser Situation ein Lungenödem zu verhindern, kann beispielsweise zusätzlich eine Impella, implantiert werden um den linken Ventrikel zu entlasten [29]. Ähnlich wie die Impella kann die ECMO im Endstadium der schweren Herzinsuffizienz als «Brücke zur Transplantation» oder als «Brücke zur Entscheidung» im kardiogenen Schock verwendetet werden.
Langzeitmanagement der schweren Herzinsuffizienz
Wenn die Symptome der Herzinsuffizienz nicht mehr kontrolliert werden können oder End-Organfunktionen drohen, sind fortgeschrittene Herzinsuffizienztherapien indiziert. Eine Voraussetzung ist natürlich, dass die medikamentöse und Device Therapie nach den Guidelines optimiert und ausgeschöpft ist. Zusätzlich sollten Patienten, die eine Indikation für eine Revaskularisation haben revaskularisiert werden und Patienten mit valvulärer Kardiopathien, falls indiziert, einen Klappenersatz erhalten.
Herztransplantation
Patienten mit schwerer, therapierefraktärer Herzinsuffizienz ohne behandelbare Ursache kommen potenziell für eine Herztransplantation in Frage, falls die konventionellen Behandlungsalternativen ausgeschöpft sind. Das in der Risikostratifizierung erhobene Risiko sollte eine Mortalität von mindestens >20% für die folgenden 12 Monate ergeben [30]. Zudem sollte gewährleistet sein, dass eine Herztransplantation das Überleben des Patienten deutlich verlängert und die Lebensqualität wesentlich verbessert. Kandidaten für eine Herztransplantation sollten motiviert und emotional stabil sein und eine hohe Compliance und Therapieadhärenz aufweisen. Eine Evaluation möglicher Komorbiditäten ist ein wichtiger Bestandteil der Vorabklärungen, um das Outcome einer Transplantation abzuschätzen [16,31]. Kontraindikationen für eine Herztransplantation sind in Tabelle 2gelistet.
Die Prätransplantationsabklärung beinhaltet eine komplette Krankheitsanamnese, körperlicher Status, Spiroergometrie, Links-Rechtsherzkatheterisierung, Evaluation einer peripheren arteriellen Verschlusskrankheit, Beurteilung von Frailty und Nutritionstatus. Weiterhin müssen Organfunktionen (Niere, Leber, Lunge) beurteilt werden und es wird ein Screening für Tumorerkrankungen und aktive Infektionen durchgeführt. Die prognostischen Scores sollten berechnet werden und weitere Untersuchungen je nach Vorliegen von Co-Morbiditäten durchgeführt werden [16]. Zusätzlich wird eine komplette psychosoziale Abklärung durchgeführt [32].

Die erste Herztransplantation wurde 1967 durchgeführt [33]. In der Schweiz wurden 2018 50 Herztransplantationen durchgeführt [35]. Das mediane Überleben liegt bei 12,5 Jahren [34]. Die häufigsten Ursachen der Langzeitmortalität sind Graftversagen, Infektionen und Multiorganversagen [34]. Die Gefahr eines letalen akuten Graftversagens ist innerhalb der ersten 30 Tage nach Transplantation am grössten. Infektiöse Komplikationen mit tödlichem Ausgang sind innerhalb der ersten 12 Monate aufgrund der hohen Dosen an Immunsuppressiva, inklusive Steroide, am häufigsten. Die Gefahr einer relevanten zellulären Abstossungsreaktion nimmt nach zwei Jahren deutlich ab. Im Langzeitverlauf gewinnt die Mortalität im Rahmen von Tumorerkrankungen, Nierenversagen und Transplantatvaskulopathie an Bedeutung [34].
Mechanische Langzeitunterstützung
Eine mechanische Herzpumpe (Ventricular Assist Device, VAD) wird zur Unterstützung der linken Kammer (LVAD), der rechten Kammer (RVAD) oder beider Kammern (BiVAD) eingesetzt. Studien zeigen ein verbessertes Überleben und eine verbesserte Lebensqualität bei Patienten mit schwerer, therapierefraktärer Herzinsuffizienz [9]. Ein VAD kann als «Brücke zur Transplantation» während der Wartezeit auf eine Transplantation eingesetzt werden. Falls ein Patient kein Transplantationskandidat ist, beispielsweise aufgrund des Alters, kann ein VAD als Destinationstherapie eingesetzt werden. Ein relevant erhöhter pulmonal vaskulärer Widerstand oder eine schwere Niereninsuffizienz sind Kontraindikation für eine Herztransplantation aber nicht für ein VAD Implantation. Sowohl der pulmonal vaskuläre Widerstand als auch eine schwere Niereninsuffizienz können sich unter einer VAD Therapie verbessern [36,37]. In diesen Fällen wird die VAD-Therapie als «Brücke zur Transplantationskandidatur» eingesetzt. Gleiches gilt bei potenziell kurativ behandelten Tumorerkrankungen, wo eine Tumorfreiheit von mindestens 5 Jahren vor einer möglichen Herztransplantation ausgewiesen werden sollte. In seltenen Fällen (bsp. fulminante Myokarditis) kann eine VAD-Therapie als «Brücke zur Erholung» eingesetzt werden.
Bei zurzeit noch fehlender, adäquater Lösung für eine langfristige rechtsventrikuläre oder biventrikuläre Herzunterstützungstherapie, bleibt die schwere rechtsventrikuläre Insuffizienz weiterhin eine Kontraindikation für die LVAD-Implantation [38].
Palliative Therapie
Von allen Patienten mit schwerer Herzinsuffizienz kommen nur wenige für eine Herztransplantation oder eine VAD-Therapie in Frage. Sind alle Behandlungsstrategien ausgeschöpft werden im Endstadium der schweren Herzinsuffizienz die Behandlungsziele von Lebensverlängerung auf Symptomkontrolle und Optimierung der Lebensqualität umgestellt [39]. Die konventionelle, rein internistisch-kardiologische Therapie ist in dieser Situation oft nicht ausreichend, um das Leiden des Patienten zu lindern und eine multidisziplinäre Behandlung mit Einbezug von Palliativmedizinern ist empfohlen. Die PAL-HF Studie zeigte, dass ein interdisziplinärer palliativer Ansatz zu einer Verbesserung der Lebensqualität sowie der Angst- und Depressionssymptomatik im Vergleich zur Standardtherapie führte [40]. Der Zugang zu palliativen Behandlungskonzepten sollte deshalb für alle Patienten mit schwerer Herzinsuffizienz niederschwellig sein. Ebenso ist eine frühzeitige Verfassung einer ausführlichen Patientenverfügung empfohlen. Falls nicht erfolgt sollte diese spätestens vor intensivmedizinisch aufwändigen Therapien erfolgen. Die individuellen Wünsche des Patienten bezüglich lebensverlängernder Massnahmen, inklusive Aktivitätsstatus eines implantierten Defibrillators, sollten regelmässig besprochen und dem erwarteten Krankheitsverlauf angepasst und entsprechend dokumentiert werden [41]. Falls möglich sollte die Entscheidung wann fortgeschrittene Herzinsuffizienztherapien (ICD, VAD-Therapie, Immunosuppression) eingestellt werden dem Patienten überlassen werden. Falls dieser nicht im Stande ist diese Entscheidung zu treffen sollten die Entscheidung durch Angehörige oder Betreuer oder ein ethisches Komitee vom Spital getroffen werden.
Zusammenfassend hat die Erkennung einer schweren Herzinsuffizienz und die frühzeitige Zuweisung in ein tertiäres Herzinsuffizienzzentrum oberste Priorität. Eine adäquate Risikostratifizierung mit Einbezug der etablierten Risikoscores, einer Spiroergometrie und einer Rechtsherzkatheteruntersuchung sollte in regelmässigen Abständen durch das Herzinsuffizienzzentrum durchgeführt werden. Die Therapiemöglichkeiten einer schweren Herzinsuffizienz haben sich insbesondere durch erhebliche technologische Fortschritte im Bereich der langfristigen Herzunterstützungssysteme (VAD) deutlich verbessert. Herzunterstützungssysteme können heute auch älteren Patienten mit gutem Therapieerfolg angeboten werden. Die Herztransplantation bleibt die Goldstandardtherapie. Diese bleibt aber aufgrund des allgemeinen Organmangels eine Rarität. Eine Anbindung an ein palliatives Care-Team sollte frühzeitig erfolgen und kann die Lebensqualität der betroffenen Patienten und deren Angehörige deutlich verbessern.
Take-Home-Messages
- Schwere Herzinsuffizienz erkennen
- Frühzeitige Zuweisung in ein tertiäres Herzinsuffizienzzentrum um weiterführende Abklärungen, Behandlungen und Nachkontrollen einzuleiten
- Frühzeitige Anbindung an ein palliative Care-Team
Literatur:
- Crespo-Leiro MG, et al.: «Advanced heart failure: a position statement of the Heart Failure Association of the European Society of Cardiology, Eur J Heart Fail, 20(11): 1505–1535, Nov. 2018, doi: 10.1002/ejhf.1236.
- Schweizerische Herzstiftung: «Herausforderung Herzinsuffizienz» [Online]. Available: www.swissheart.ch/de/forschung/medizinische-fortschritte/herzinsuffizienz.html
- Xanthakis V, et al.: Prevalence, Neurohormonal Correlates, and Prognosis of Heart Failure Stages in the Community, JACC Heart Fail, 4(10): 808–815, Jun. 2016, doi: 10.1016/j.cardfail.2016.03.003.
- Bjork JB, Alton KK, Georgiopoulou VV, et al.: Defining Advanced Heart Failure: A Systematic Review of Criteria Used in Clinical Trials, J Card Fail, 22(7): 569–577, Jul. 2016, doi: 10.1016/j.cardfail.2016.03.003.
- Fang JC, et al.: Advanced (stage D) heart failure: a statement from the Heart Failure Society of America Guidelines Committee, J Card Fail 21(6): 519–534, Jun. 2015, doi: 10.1016/j.cardfail.2015.04.013.
- Metra M, et al.: Advanced chronic heart failure: A position statement from the Study Group on Advanced Heart Failure of the Heart Failure Association of the European Society of Cardiology, Eur J Heart Fail 9(6–7): 684–694, 2007, doi: 10.1016/j.ejheart.2007.04.003.
- Yancy CW, et al.: 2013 ACCF/AHA guideline for the management of heart failure: executive summary: a report of the American College of Cardiology Foundation/American Heart Association Task Force on practice guidelines, Circulation 128(16), 1810–1852, Oct. 2013, doi: 10.1161/CIR.0b013e31829e8807.
- Hunt SA, et al.: 2009 Focused update incorporated into the ACC/AHA 2005 Guidelines for the Diagnosis and Management of Heart Failure in Adults A Report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines Developed in Collaboration With the International Society for Heart and Lung Transplantation, J Am Coll Cardiol 53(15): e1–e90, Apr. 2009, doi: 10.1016/j.jacc.2008.11.013.
- Ponikowski P, et al.: 2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure: The Task Force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC). Developed with the special contribution, Eur J Heart Fail 18(8): 891–975, Aug. 2016, doi: 10.1002/ejhf.592.
- Aaronson KD, Schwartz JS, Chen TM, et al.: Development and prospective validation of a clinical index to predict survival in ambulatory patients referred for cardiac transplant evaluation, Circulation, 95(12): 2660–2667, Jun. 1997, doi: 10.1161/01.cir.95.12.2660.
- Levy WC, et al.: The Seattle Heart Failure Model: prediction of survival in heart failure, Circulation 113(11): 1424–1433, Mar. 2006, doi: 10.1161/CIRCULATIONAHA.105.584102.
- Agostoni P, et al.: Metabolic exercise test data combined with cardiac and kidney indexes, the MECKI score: a multiparametric approach to heart failure prognosis, Int J Cardiol 167(6): 2710–2718, Sep. 2013, doi: 10.1016/j.ijcard.2012.06.113.
- Agostoni P, et al.: Multiparametric prognostic scores in chronic heart failure with reduced ejection fraction: a long-term comparison, Eur. J Heart Fail 20(4): 700–710, Apr. 2018, doi: 10.1002/ejhf.989.
- Corra U, et al.: The metabolic exercise test data combined with Cardiac And Kidney Indexes (MECKI) score and prognosis in heart failure. A validation study, Int J Cardiol 203: 1067–1072, Jan. 2016, doi: 10.1016/j.ijcard.2015.11.075.
- Pocock SJ, et al.: Predicting survival in heart failure: a risk score based on 39 372 patients from 30 studies, Eur Heart J 34(19): 1404–1413, May 2013, doi: 10.1093/eurheartj/ehs337.
- Mehra MR, et al.: The 2016 International Society for Heart Lung Transplantation listing criteria for heart transplantation: A 10-year update, J. Heart Lung Transplant 35(1): 1–23, Jan. 2016, doi: 10.1016/j.healun.2015.10.023.
- Alahdab MT, Mansour IN, Napan S, Stamos TD: Six minute walk test predicts long-term all-cause mortality and heart failure rehospitalization in African-American patients hospitalized with acute decompensated heart failure, J Card Fail 15(2): 130–135, Mar. 2009, doi: 10.1016/j.cardfail.2008.10.006.
- Guazzi M, Dickstein K, Vicenzi M, Arena R: Six-minute walk test and cardiopulmonary exercise testing in patients with chronic heart failure: a comparative analysis on clinical and prognostic insights, Circ Heart Fail 2(6): 549–555, Nov. 2009, doi: 10.1161/CIRCHEARTFAILURE.109.881326.
- Hulsmann M, et al.: Prediction of outcome by neurohumoral activation, the six-minute walk test and the Minnesota Living with Heart Failure Questionnaire in an outpatient cohort with congestive heart failure, Eur Heart J 23(11): 886–891, Jun. 2002, doi: 10.1053/euhj.2001.3115.
- Wolsk E, et al.: Resting and exercise haemodynamics in relation to six-minute walk test in patients with heart failure and preserved ejection fraction, Eur J Heart Fail 20(4): 715–722, Apr. 2018, doi: 10.1002/ejhf.976.
- Costanzo MR, et al.: Extracorporeal Ultrafiltration for Fluid Overload in Heart Failure: Current Status and Prospects for Further Research, J Am Coll Cardiol 69(19): 2428–2445, May 2017, doi: 10.1016/j.jacc.2017.03.528.
- Cuffe MS, et al.: Short-term intravenous milrinone for acute exacerbation of chronic heart failure: a randomized controlled trial, JAMA 287(12): 1541–1547, Mar. 2002, doi: 10.1001/jama.287.12.1541.
- O’Connor CM, et al.: Continuous intravenous dobutamine is associated with an increased risk of death in patients with advanced heart failure: insights from the Flolan International Randomized Survival Trial (FIRST), Am Heart J 138(1) Pt 1: 78–86, Jul. 1999, doi: 10.1016/s0002-8703(99)70250-4.
- Packer M, et al.: Effect of levosimendan on the short-term clinical course of patients with acutely decompensated heart failure, JACC Heart Fail 1(2): 103–111, Apr. 2013, doi: 10.1016/j.jchf.2012.12.004.
- Comín-Colet J, et al.: Efficacy and safety of intermittent intravenous outpatient administration of levosimendan in patients with advanced heart failure: the LION-HEART multicentre randomised trial, Eur J Heart Fail 20(7): 1128–1136, Jul. 2018, doi: 10.1002/ejhf.1145.
- Altenberger J, et al.: Efficacy and safety of the pulsed infusions of levosimendan in outpatients with advanced heart failure (LevoRep) study: a multicentre randomized trial, Eur J Heart Fail 16(8): 898–906, Aug. 2014, doi: 10.1002/ejhf.118.
- Unverzagt S, et al.: Intra-aortic balloon pump counterpulsation (IABP) for myocardial infarction complicated by cardiogenic shock, Cochrane database Syst Rev 3: CD007398–CD007398, Mar. 2015, doi: 10.1002/14651858.CD007398.pub3.
- Costanzo MR, et al.: Ultrafiltration versus intravenous diuretics for patients hospitalized for acute decompensated heart failure, J Am Coll Cardiol 49(6): 675–683, Feb. 2007, doi: 10.1016/j.jacc.2006.07.073.
- Pappalardo F, et al.: Concomitant implantation of Impella® on top of veno-arterial extracorporeal membrane oxygenation may improve survival of patients with cardiogenic shock, Eur J Heart Fail 19(3): 404–412, Mar. 2017, doi: 10.1002/ejhf.668.
- Ammirati E, et al.: Current indications for heart transplantation and left ventricular assist device: a practical point of view, Eur J Intern Med 25(5): 422–429, Jun. 2014, doi: 10.1016/j.ejim.2014.02.006.
- Lund LH, et al.: The Registry of the International Society for Heart and Lung Transplantation: Thirty-third Adult Heart Transplantation Report-2016; Focus Theme: Primary Diagnostic Indications for Transplant, J Heart Lung Transplant 35(10): 1158–1169, Oct. 2016, doi: 10.1016/j.healun.2016.08.017.
- Lund LH, et al.: The registry of the International Society for Heart and Lung Transplantation: thirty-first official adult heart transplant report–2014; focus theme: retransplantation, J Heart Lung Transplant 33(10): 996–1008, Oct. 2014, doi: 10.1016/j.healun.2014.08.003.
- Barnard CN: The operation. A human cardiac transplant: an interim report of a successful operation performed at Groote Schuur Hospital, Cape Town, S Afr Med J 41(48): 1271–1274, Dec. 1967.
- Chambers DC, et al.: The International Thoracic Organ Transplant Registry of the International Society for Heart and Lung Transplantation: Thirty-sixth adult lung and heart-lung transplantation Report-2019; Focus theme: Donor and recipient size match, J Heart Lung Transplant 38(10): 1042–1055, Oct. 2019, doi: 10.1016/j.healun.2019.08.001.
- Bundesamt für Gesundheit, BAG: Zahlen zur Spende und Transplantation von Organen in der Schweiz. [Online]. Available: www.bag.admin.ch/bag/de/home/zahlen-und-statistiken/zahlen-fakten-zu-transplantationsmedizin/zahlen-fakten-zur-spende-und-transplantation-von-organen.html#-1057919152.
- Hasin T, et al.: Changes in renal function after implantation of continuous-flow left ventricular assist devices, J Am Coll Cardiol 59(1): 26–36, Jan. 2012, doi: 10.1016/j.jacc.2011.09.038.
- Mikus E, et al.: Reversibility of fixed pulmonary hypertension in left ventricular assist device support recipients, Eur J Cardiothorac Surg 40(4): 971–977, Oct. 2011, doi: 10.1016/j.ejcts.2011.01.019.
- Harjola VP, et al.: Contemporary management of acute right ventricular failure: a statement from the Heart Failure Association and the Working Group on Pulmonary Circulation and Right Ventricular Function of the European Society of Cardiology, Eur J Heart Fail 18(3): 226–241, Mar. 2016, doi: 10.1002/ejhf.478.
- Whellan DJ, et al.: End-of-life care in patients with heart failure, J Card Fail 20(2): 121–134, Feb. 2014, doi: 10.1016/j.cardfail.2013.12.003.
- Rogers JG, et al.: Palliative Care in Heart Failure: The PAL-HF Randomized, Controlled Clinical Trial, J Am Coll Cardiol, vol. 70, no. 3, pp. 331–341, Jul. 2017, doi: 10.1016/j.jacc.2017.05.030.
- Bayoumi E, Sheikh F, Groninger H: Palliative care in cardiac transplantation: an evolving model, Heart Fail Rev 22(5): 605–610, Sep. 2017, doi: 10.1007/s10741-017-9613-8.
CARDIOVASC 2020; 19(1): 6–11
Autoren
- Dr. med. univ. Linn Ryberg Almqvist
- Prof. Dr. med. Otmar Pfister
Publikation
- CARDIOVASC




Comments are closed.