Die Nephroprotektion umfasst Interventionen, die den GFR-Abfall über die Zeit verlangsamen und somit das Endstadium-Nierenversagen hinauszögern. Die neueste Intervention besteht im Einsatz von SGLT2-Hemmern bei Patienten mit diabetischer Nephropathie.
Eine chronische Niereninsuffizienz kann auf zwei Arten diagnostiziert werden:
- Nachweis einer eingeschränkten Nierenfunktion mit einer errechneten glomerulären Filtrationsrate (eGFR) von unter 60 ml/min, die über mindestens drei Monate besteht.
- Nachweis eines chronischen Nierenschadens (Albuminurie, Hämaturie, bildgebender Nachweis wie z.B. polyzystische Nieren), der über mindestens drei Monate besteht – unabhängig von der eGFR.
Die Diagnose der chronischen Niereninsuffizienz kann somit in der Praxis mit drei einfachen Untersuchungen gestellt werden: Kreatininbestimmung (daraus eGFR berechnen), Urinstatus mit Sediment und Proteinurie (Spoturin) und Nierensonografie.
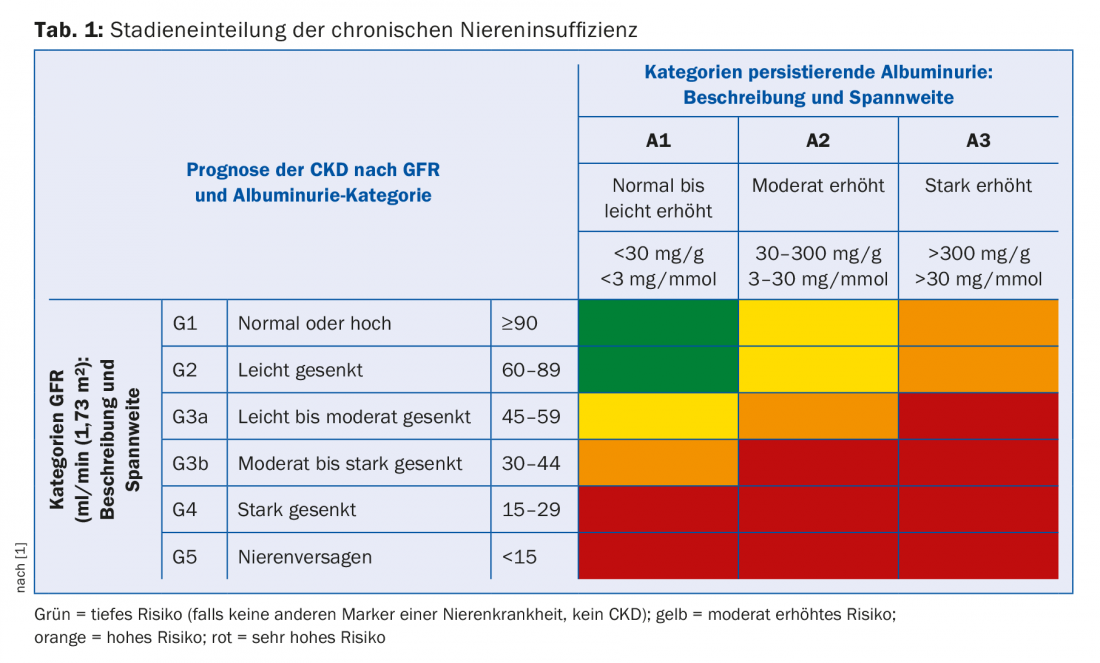
Abhängig vom Ausmass der Nierenfunktionseinschränkung und der Albuminurie erfolgt die Stadieneinteilung der chronischen Niereninsuffizienz. eGFR und Albuminurie sind unabhängige Risikofaktoren sowohl für die kardiovaskuläre Mortalität wie auch für das Risiko, ein Endstadium-Nierenversagen zu entwickeln [1]. Die Stadieneinteilung gibt deshalb Hinweise, wie oft solche Patienten kontrolliert und wie aggressiv sie bezüglich kardiovaskulärer Risiken behandelt werden sollten (Tab. 1). Weiter gibt das Ausmass der Nierenfunktionseinschränkung Hinweise darauf, mit welchen Sekundärkomplikationen zu rechnen ist (Tab. 2). Diese sollten aktiv gesucht und, wenn nötig, behandelt werden.
Verlauf
Die chronische Niereninsuffizienz verläuft über die Jahre progredient, unabhängig davon, ob die Grundkrankheit noch aktiv ist oder nicht. Dieses Phänomen wird mit der sog. «Brenner-Hypothese» erklärt, die besagt, dass mit dem Verlust einer grösseren Anzahl von Nephronen die noch verbleibenden Nephrone den Funktionsverlust mindestens teilweise kompensieren und somit hyperfiltrieren. Diese über längere Zeit bestehende Hyperfiltration führt zur Schädigung der noch intakten Nephrone. Histologisch lässt sich zuerst eine glomeruläre Hypertrophie und anschliessend eine zunehmende Glomerulosklerose nachweisen, die in einem progredienten Funktionsverlust sowie Auftreten einer Albuminurie resultiert.
Die Progression der chronischen Niereninsuffizienz kann mit der sog. Mitch-Kurve individuell pro Patient beschrieben werden [2]. Trägt man die eGFR oder den Wert 1/Kreatinin über die Zeit auf, dann ergibt sich eine linear abfallende Kurve. Mit dieser Kurve lässt sich für einen individuellen Patienten das Risiko, ein Endstadium-Nierenversagen zu entwickeln, abschätzen (Abb. 1A). Dies erleichtert das Gespräch mit dem Patienten und erlaubt, rechtzeitig die Vorbereitungen für die Einleitung eines Nierenersatzverfahrens zu treffen.
Gerne möchten wir als Ärzte die Progression der chronischen Niereninsuffizienz günstig beeinflussen. Unter «nephroprotektiven Massnahmen» verstehen wir alle Interventionen, die den Abfall der eGFR über die Zeit verlangsamen. Zwar gibt es bis heute keine Intervention, um diesen Abfall gänzlich zu stoppen. Aber wenn es gelingt, den Abfall der Mitch-Kurve nur ein wenig zu verflachen, dann gewinnt der Patient unter Umständen mehrere Jahre Dialyse-freier Zeit (Abb. 1B).
Nephroprotektion
Erste Generation – Blockade des Renin-Angiotensin-Systems: Das Renin-Angiotensin-System (RAS) ist entscheidend beteiligt an der Regulation des renalen Blutflusses und somit der Perfusion der einzelnen Glomeruli. Angiotensin beeinflusst direkt den Tonus des Vas efferens. Mehr Angiotensin führt zur Konstriktion des Vas efferens und damit zur Erhöhung des Filtrationsdruckes im glomerulären Kapillarbett. Das erlaubt einerseits die Autoregulation der glomerulären Filtration über eine grosse Spanne von Blutdruckschwankungen. Andererseits führt es auch zur oben erwähnten Hyperfiltration im Rahmen der Brenner-Hypothese. Die Blockierung des RAS mit ACE-Hemmern, Typ 1-Angiotensin-Rezeptorblockern (Sartane) oder Renin-Inhibitoren führt zur Dilatation des efferenten Gefässes am Glomerulum. Dadurch wird der glomeruläre Perfusionsdruck gesenkt und das glomeruläre Kapillarbett geschont. Gleichzeitig sinkt aber auch die glomeruläre Filtrationsrate pro Nephron und insgesamt. Der Beginn einer RAS-Blockade beim niereninsuffizienten Patienten führt demnach immer zu einem Kreatininanstieg. Ein solcher darf bis zu einem Anstieg von 25% toleriert werden, sofern er anschliessend auf diesem Niveau stabil bleibt. Der Kreatininanstieg ist funktionell und der Beweis dafür, dass der glomeruläre Perfusionsdruck in der Tat gesenkt werden konnte. Wird die RAS-Blockade wieder gestoppt, fällt das Kreatinin um den gleichen Wert wieder ab. Sollte sich der Kreatininwert nach Einführung der RAS-Blockade nicht stabilisieren, muss diese wieder gestoppt und eine Nierenarterienstenose gesucht werden.
In mehreren randomisierten Studien in den 1990er Jahren konnte gezeigt werden, dass die RAS-Blockade die Progression des chronischen Nierenversagens bremsen kann, sowohl bei diabetischer wie bei nicht-diabetischer Nephropathie [3]. Die RAS-Blockade ist somit heute die Grundlage jeder nephroprotektiven Intervention und soll umso aggressiver gemacht werden, je höher die Proteinurie ist. Dabei sollen individuelle Substanzen maximal ausdosiert werden, eine doppelte RAS-Blockade ist strikt zu vermeiden [4].
Zweite Generation – Korrektur der metabolischen Azidose: Die Niere ist das wichtigste Organ zur Ausscheidung von fixen Säuren, und diese akkumulieren mit zunehmender Einschränkung der Nierenfunktion. Das chronische Nierenversagen ist deshalb meist mit dem Auftreten einer metabolischen Azidose verbunden, vor allem in den fortgeschrittenen Stadien ab CKD G3b.
Die metabolische Azidose hat verschiedene ungünstige Auswirkungen. Sie beeinträchtigt die Knochengesundheit und begünstigt das Auftreten einer Hyperkaliämie, die wiederum das Risiko von Herzrhythmusstörungen erhöht. Ob jedoch die metabolische Azidose die Progression des chronischen Nierenversagens selber beeinflusst, war lange Zeit unklar. In den 2000er Jahren sind dann mehrere randomisierte Studien publiziert worden, wo der Einfluss einer Behandlung der metabolischen Azidose mit Natrium-Bikarbonat auf die Progression des chronischen Nierenversagens untersucht wurde. Zur Überraschung vieler Nephrologen konnte gezeigt werden, dass in verschiedenen Stadien der chronischen Niereninsuffizienz (CKD G2, G3 und G4) die Progression mit dieser einfachen Massnahme verlangsamt und das Auftreten eines Endstadium-Nierenversagens verzögert werden kann [5]. Somit gehört es heute zu den allgemeinen Empfehlungen, dass eine metabolische Azidose mit einem Serum-Bikarbonat <20 mmol/l mit Natrium-Bikarbonat behandelt werden soll. Dadurch bessert sich auch die Hyperkaliämie, was wiederum erlaubt, eine möglichst effiziente RAS-Blockade aufrechtzuerhalten.
Limitierend bei dieser Intervention sind oft die Verträglichkeit (Natrium-Bikarbonat verursacht Blähungen), die hohe Tablettenzahl (um ein Serum-Bikarbonat >20 mmol/l zu erreichen, sind manchmal sechs bis acht Tabletten pro Tag nötig) und die Natriumbelastung, die zu vermehrten Ödemen und/oder Blutdruckanstieg führen kann.
Dritte Generation – Blockade des Natrium/Glukose-Kotransporters SGLT2 im proximalen Tubulus: In den letzten Jahren ist eine neue Gruppe von oralen Antidiabetika in mehreren randomisierten Studien getestet worden: Es handelt sich um Hemmer des Natrium/Glukose-Kotransporters im proximalen Tubulus (SGLT2, «sodium-glucose transporter 2»). Diese Medikamente induzieren eine Glukosurie. Dadurch wird ein besseres HbA1c erreicht und eine negative Kalorienbilanz, die zu einer Netto-Gewichtsabnahme führt. Gleichzeitig führt die Blockade von SGLT2 jedoch auch zu einer Natriurese. Diese Substanzen sind somit eine neue Klasse von Diuretika, die im Gegensatz zu Schleifendiuretika und Thiaziden nicht im distalen Nephron, sondern im proximalen Tubulus wirken.
SGLT2-Hemmer wurden bisher vor allem bei Patienten mit Typ 2-Diabetes und einem erhöhten kardiovaskulären Risikoprofil (oft in der Sekundärprophylaxe) getestet. Es konnte hier ein hochsignifikanter Benefit auf die Gesamtsterblichkeit (Empagliflozin) sowie die kardiovaskuläre Mortalität (Empagliflozin, Canagliflozin) gezeigt werden. Aufgrund der diuretischen Wirkung konnten zudem Rehospitalisationen aufgrund einer dekompensierten Herzinsuffizienz signifikant gesenkt werden [6,7].
In Folgestudien wurde nun auch ein hochsignifikanter positiver Effekt auf harte renale Endpunkte gezeigt (Neuauftreten einer Makroalbuminurie, Verdoppelung des Serum-Kreatinins, Auftreten eines Endstadium-Nierenversagens). Der Effekt ist in der Grössenordnung der RAS-Blockade in einer Patientengruppe, die zum grössten Teil schon mit RAS-Blockern behandelt ist [8]! Der Mechanismus der Nephroprotektion ist noch nicht im Detail geklärt. Es wird aber eine Wirkung über die Macula densa mit Dilatation des Vas afferens postuliert. Der gleiche funktionelle Kreatininanstieg zu Beginn der Behandlung mit anschliessender Stabilisierung der Nierenfunktion wie bei der RAS-Blockade wurde gezeigt [9].
Zu beachten sind bei dieser Substanzklasse zwei klinische Nebenwirkungen: Häufig, aber harmlos sind vermehrt auftretende urogenitale Infektionen, die einfach behandelt werden können. Eine seltene, aber schwerwiegende Komplikation stellt die euglykäme diabetische Ketoazidose dar, die bei Insulinmangel und langen Fastenperioden auftreten kann. In den in Tabelle 3 aufgeführten klinischen Situationen sollten deshalb SGLT2-Hemmer nicht oder nur mit grosser Vorsicht eingesetzt bzw. vorübergehend pausiert werden.
Schlussfolgerung
Nach der RAS-Blockade und der Therapie der metabolischen Azidose steht uns nun seit zwei Jahren eine dritte nephroprotektive Massnahme zur Verfügung: der Einsatz von SGLT2-Hemmern. Diese ist im Moment nur bei Patienten mit diabetischer Nephropathie zugelassen (Tab. 4). Da der Mechanismus der Nephroprotektion mit grösster Wahrscheinlichkeit nichts mit dem Einfluss auf den Glukose-Stoffwechsel, sondern mit der diuretischen Wirkung dieser Substanzen zu tun hat, ist anzunehmen, dass sie auch bei nicht-diabetischer Nephropathie wirken würden. Die entsprechenden Studien dazu sind aktuell im Gange.
Take-Home-Messages
- Die chronische Niereninsuffizienz hat einen progredienten Verlauf, der mit der Mitch-Kurve beschrieben werden kann.
- Unter nephroprotektiven Massnahmen verstehen wir Interventionen, die den GFR-Abfall über die Zeit verlangsamen und somit das Endstadium-Nierenversagen hinauszögern können.
- Grundlage jeglicher Nephroprotektion ist der Einsatz von Hemmern des Renin-Angiotensin-Systems (ACE-Hemmer, AT1-Rezeptorblocker, Renin-Inhibitoren). Diese sollen nach Verträglichkeit ausdosiert, aber nicht kombiniert werden.
- Die Behandlung der metabolischen Azidose mit Natrium-Bikarbonat ist nephroprotektiv und soll bei einem Serum-Bikarbonat <20 mmol/l begonnen werden.
- Die neueste Intervention besteht im Einsatz von SGLT2-Hemmern bei Patienten mit diabetischer Nephropathie. Sie wirken diuretisch am proximalen Tubulus und sind kardio- und nephroprotektiv.
Literatur:
- Stevens PE, Levin A: Evaluation and management of chronic kidney disease: synopsis of the kidney disease: improving global outcomes 2012 clinical practice guideline. Ann Intern Med 2013; 158: 825–830.
- Mitch WE, et al.: A simple method of estimating progression of chronic renal failure. Lancet 1976; 2: 1326–1328.
- Lewis EJ, et al.: The effect of angiotensin-converting-enzyme inhibition on diabetic nephropathy. The Collaborative Study Group. N Engl J Med 1993; 329: 1456–1462.
- Luft FC: Perspective on combination RAS blocking therapy: off-TARGET, dis-CORD, MAP-to-nowhere, low ALTITUDE, and NEPHRON-D. Am J Nephrol 2014; 39: 46–49.
- de Brito-Ashurst I, et al.: Bicarbonate supplementation slows progression of CKD and improves nutritional status. J Am Soc Nephrol 2009; 20: 2075–2084.
- Zinman B, et al.: Empagliflozin, Cardiovascular Outcomes, and Mortality in Type 2 Diabetes. N Engl J Med 2015; 373: 2117–2128.
- Neal B, et al.: Canagliflozin and Cardiovascular and Renal Events in Type 2 Diabetes. N Engl J Med 2017; 377: 644–657.
- Wanner C, et al.: Empagliflozin and Progression of Kidney Disease in Type 2 Diabetes. N Engl J Med 2016; 375: 323–334.
- Anders HJ, et al.: Nephron Protection in Diabetic Kidney Disease. N Engl J Med 2016; 375: 2096–2098.
HAUSARZT PRAXIS 2018; 13(4): 22–25
CARDIOVASC 2019; 18(5): 6–9
Autoren
- Prof. Dr. med. Thomas Fehr
Publikation
- HAUSARZT PRAXIS



Comments are closed.