Weltweit gibt es 400 Millionen COPD-Betroffene. Es handelt sich um die vierthäufigste globale Mortalitätsursache. Beim Innere Medizin Update Refresher 2017 in Zürich wurden die neusten Erkenntnisse für evidenzbasierte Diagnostik und Therapie vorgestellt.
Weltweit gibt es 400 Millionen COPD-Betroffene. Es handelt sich um die vierthäufigste globale Mortalitätsursache [1]. In der Schweiz gibt es 300 000 Betroffene, wobei die Prävalenz bei 30–39-jährigen 2,5% und bei >70-jährigen 8% beträgt. Zu den Risikofaktoren zählen neben Tabakrauchen auch Staubpartikelexposition (z.B. in der Landwirtschaft) und Rauchpartikelexposition von Holzheizungen. Für eine möglichst spezifische, auf die individuellen Bedürfnisse abgestimmte Behandlung, wurden die diagnostischen und therapeutischen Leitlinien dem aktuellen Stand der Forschung angepasst. Der Stellenwert von Bronchodilatatoren (LAMA = langwirksame Anticholinergika/LABA = langwirksame β-2-Agonisten) habe in den vergangenen Jahren stark zugenommen, hingegen werden inhalative Steroide (ICS) weniger häufig als früher eingesetzt, berichtete Prof. Dr. med. Robert Thurnheer, Chefarzt Medizin-Diagnostik, Kantonsspital Münsterlingen.
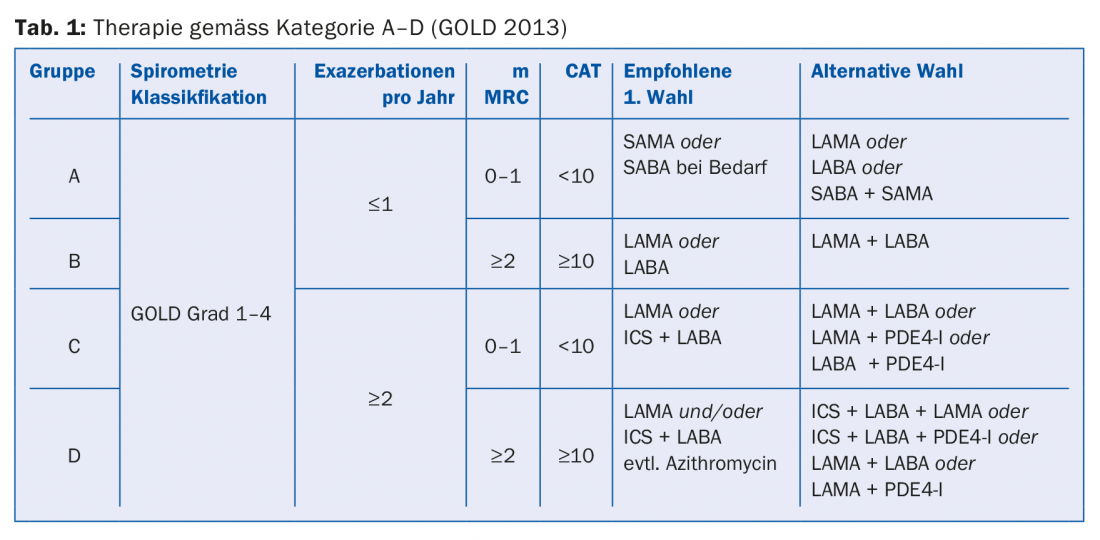
Phänotypisierung gemäss «Global Initiative for Chronic Obstructive Lung Disease» (GOLD)
Die aktuell gültige Einteilung A–D (Tab. 1) erfolgt nicht mehr anhand der Lungenfunktion, sondern auf der Basis von Symptomen und Exazerbationsrisiko und dient als Grundlage für eine evidenzbasierte Therapie. Als diagnostische Hilfsmittel werden die Fragebögen «CAT» (COPD-Assessment-Test) und «mMRC» (Dyspnoe-Screening) eingesetzt. Für Patienten der Gruppe A (wenig Symptome, keine Exazerbationen) kann ein Bronchodilatator (LABA oder LAMA) eingesetzt werden. Bei Patienten der Gruppe B (Symptome, aber keine Exazerbationen) sollte ebenfalls ein Bronchodilatator eingesetzt werden. Falls die Symptome persistieren, sollte man auf ein Kombinationspräparat (Anoro® oder Spiolto® oder Ultibro®) wechseln. Falls vermehrt Exazerbationen auftreten ist die Kombination mit einem inhalierbaren Steroid (ICS) gemäss GOLD-Guidelines empfohlen. Bei Patienten der Gruppe C (Exazerbationen) ist die erste Wahl eine Monotherapie mit LAMA. Falls weiterhin Exazerbationen auftreten, sollte auf eine Kombinationstherapie umgestellt werden: LABA und LAMA oder LABA und ICS. Die Therapie von Gruppe D kann auch nach einem Stufenschema erfolgen (Tab. 1), wobei Professor Thurnheer betreffend prophylaktischem Einsatz von Makroliden aufgrund von Nebenwirkungsrisiken (z.B. Innenohrschwerhörigkeit, long-QT-syndrome, Resistenzen, fehlende Langzeitdaten) zu Vorsicht riet.
Bronchodilatation: Was ist der therapeutische Nutzen und wie erzielt man die besten Effekte?
Zusammengefasst sprechen folgende Argumente für die Wirksamkeit der Bronchodilatation (LAMA, LABA): Verbesserung der Lungenfunktion [2], Abnahme der Überblähung [3], Besserung der Symptome [4], Abnahme der Exazerbationsrate [4]. Für Gruppe A und B spielt es keine Rolle, ob LABA oder LAMA zuerst angewendet werden. Für Gruppe C und D wird empfohlen LAMA zuerst einzusetzen. In der POET-Studie zeigte sich LAMA (Spiriva®) überlegen gegenüber Salmeterol (Serevent®) bezüglich Verhinderung von Exazerbationen [5].
Gemäss neuer Erkenntnisse wirkt sich ein möglichst früher Therapiebeginn (d.h. im lungenfunktionellen Stadium 2 = FEV1 50–80% Soll) positiv aus; beispielsweise zeigte sich in Studien, dass bei Anwendung von Tiotropium (Spiriva®) die Abnahme der FEV1 (Forciertes exspiratorisches Volumen in der ersten Ausatmungssekunde) nach zwei Jahren weniger stark ausgeprägt ist als in der Placebobedingung [6] und Patienten auch in einem frühen Stadium bei Belastung weniger von «Hyperinflation» (dynamische Überblähung) betroffen sind.
In mehreren klinischen Studien [7,8] zeigte sich, dass Kombinationspräparate von LAMA und LABA (Anoro®, Spiolto®, Ultibro®) einer Monotherapie (LAMA oder LABA) überlegen sind betreffend folgender Targets: bessere Lungenfunktion, weniger Symptome, Abnahme der Exazerbationsrate. In der SPARK-Studie, konnte beispielsweise gezeigt werden, dass Ultibro® bessere Effekte erzielt als die jeweiligen Einzelsubstanzen [7]. Der Einsatz eines Kombinationspräparates wird vor allem für COPD-Patienten mit ungenügendem Ansprechen auf tiefdosierte Monotherapie mit LAMA oder LABA empfohlen [9] und für Patienten mit schwerer COPD und Dyspnoe-Symptomen [10,11].
Gemäss Kompendium ist immer zunächst eine Monotherapie durchzuführen und erst bei mangelnden Effekten ein Kombinationspräparat anzuwenden, gemäss Guidelines ist aber auch eine primäre Behandlung mit einem Kombinationspräparat erlaubt. Für die Entscheidung, welches der drei Kombinationspräparate (Anoro®, Ultibro®, Spiolto®) angewendet wird, kann neben der Wirksamkeit auch das Handling eine Rolle spielen.
Inhalative Korticosteroide (ICS): Kontroverse betreffend therapeutischem Nutzen
Im Gegensatz zu Asthma, wo inhalative Steroide (ICS) die Basis-Behandlung darstellen, wird die Anwendung von ICS bei COPD kontrovers diskutiert.
In der FLAME-Studie [12] erreichte man mit kombinierten Bronchodilatatoren (LABA+LAMA) eine signifikant stärkere Verringerung von Exazerbationen im Vergleich zu LABA+ICS. In der WISDOM-Studie [8] führte das Weglassen von ICS nicht zu einer Zunahme der Häufigkeit von Exazerbationen, wobei sich bei den Patienten ohne ICS im Langzeitverlauf Verschlechterungen in den Werten der FEV1 zeigten [8]. Bei einer Subgruppe von COPD-Patienten mit Eosinophilie (>2% Blut-Eosinophilie) und erhöhtem Exazerbationsrisiko bewirkten ICS eine Verringerung der Exazerbationsrate [13,14]. Bei COPD-Patienten mit erhöhtem kardiovaskulärem Risiko konnte gemäss SUMMIT-Studie (n=16 485, 43 Länder) durch die Anwendung von ICS keine Verringerung der Mortalitätsrate erzielt werden, hingegen eine geringfügige Verringerung der «rate of decline» der Lungenfunktion [15].
Die Effekte einer kombinierten Anwendung von Bronchodilatatoren und ICS («triple therapy») kann nach aktuellem Stand der Forschung folgendermassen zusammengefasst werden [16]: kein Einfluss auf Mortalität und kardiovaskuläre Endpunkte, kaum Einfluss auf Lungenfunktion, etwas Exazerbations-Reduktion [17,18], aber deutlich mehr Pneumonien (Nebenwirkung von ICS).
Therapie der fortgeschrittenen COPD: «Treatable traits» und verhaltensmedizinische Massnahmen
Das Präparat Prolastin® kann bei einem Mangel an α-1-Antitrypsin (Protease-Inhibitor) als Substitution eingesetzt werden, wobei bisher lediglich für lungenstrukturelle Kriterien positive Effekte gezeigt wurden. Daxas® (Wirkstoff: Roflumilast) führt zu einer leichten Verbesserung der Lungenfunktion und einer leicht signifikanten Abnahme der Exazerbationsrate, wobei auch Nebenwirkungen auftreten können: Gewichtsabnahme, erhöhtes Risiko für Schlafstörungen, Stimmungsschwankungen [19]. Mepolizumab (z.B. Nucala®) wird bereits für Asthmatiker mit Eosinophilie erfolgreich eingesetzt und auch bei COPD und Eosinophilie können damit positive Effekte bezüglich Reduktion der Exazerbationsrate erzielt werden, wobei das Präparat für COPD-Patienten aktuell noch nicht für diese Indikation zugelassen ist [20].
Betreffend Sauerstoff-Therapie bei schwerer Hypoxämie erwähnte Professor Thurnheer, dass ein Überlebensvorteil erst nach etwa vier Jahren Therapie signifikant wird und dass sich bei lediglich leichter Hypoxämie hinsichtlich subjektiver Lebensqualität, Hospitalisations- und Exazerbationsrisiko keine Effekte zeigten [21].
Hinsichtlich verhaltensmedizinischer Massnahmen hat sich neben der Unterstützung eines Rauchstopps, Physiotherapie und Ernährungsberatung (häufig kalorische Mangelernährung aufgrund von Emphysem und Muskelwasting) bewährt. Für den Fall von Exazerbationen wird das Erstellen eines Aktionsplans empfohlen. So sollte man beispielsweise auf Reisen systemische Steroide (fünf Tagesdosen à 40 mg) [22] und bei bronchialer Symptomatik Antibiotika (z.B. Co-Amoxicillin, Tetrazyklin, u.a.) in Reserve haben. Als weitere Massnahmen werden Kontrolle der Inhalationstechnik, jährliche Grippeimpfung und einmalige Pneumokokkenimpfung (Prevenar-13® bei Kindern) genannt.
Quelle: Innere Medizin Update Refresher, 5.–9.Dezember 2017, Zürich
Literatur:
- Bridevaux P-O, et al.: Prevalence of airflow obstruction in smokers and never-smokers in Switzerland. European Respiratory Journal 2010; 36: 1259–1269.
- Tashkin DP, et al.: Bronchodilator responsiveness in patients with COPD. European Respiratory Journal 2008; 31: 742–750.
- Dellaca RL, et al.: Effect of bronchodilation on expiratory flow-limitation and resting lung mechanics in COPD. European Respiratory Journal 2009; 33: 1329–1337.
- Jones PW, et al.: Correlating changes in lung function with patient outcomes in chronic obstructive pulmonary disease: a pooled analysis. Respir Res 2011; 12: 161.
- Vogelmeier C, et al.: Tiotropium versus salmeterol for the prevention of Exacerbations of COPD (POET). N Engl J Med 2011; 364: 1093–1103.
- Zhou Y, et al.: Tiotropium in Early-Stage Chronic Obstructive Pulmonary Disease. N Engl J Med 2017; 377: 923–935.
- Wedzicha JA, et al.: Analysis of chronic obstructive pulmonary disease exacerbations with the dual bronchodilator QVA149 compared with glycopyrronium and tiotropium (SPARK): a randomised, double-blind, parallel-group study. Lancet Respir Med 2013; 1: 199–209.
- Magnussen H, et al.: Withdrawal of inhaled glucocorticoids and Exacerbations of COPD. N Eng J Med 2014; 371: 1285–1294.
- Donohue JF, et al.: Efficacy and safety of once-daily umeclidinium/vilanterol 62.5/25 mcg in COPD. Respir Med 2013; 107(10): 1538–1546.
- Kessler R, et al.: Symptom variability in patients with severe COPD; a pan European cross-sectional study. Eur Respir J 2011; 37: 264–272.
- Price D, et al.: Impact of night-time symptoms in COPD, a real-world study in five European countries. Int J Chron Obstruct Pulmon Dis 2013; 8: 595–603.
- Wedzicha JA, et al.: Indacaterol-Glycopyrronium versus Salmeterol-Fluticasone for COPD. N Engl J Med 2016; 374(23): 2222–2234.
- Vedel-Krogh S, et al.: Blood Eosinophils and Exacerbations in Chronic Obstructive Pulmonary Disease. The Copenhagen General Population Study. AJRCCM 2016; 93(9): 965–974.
- Pascoe S, et al.: Blood eosinophil counts, exacerbations, and response to the addition of inhaled fluticasone furoate to vilanterol in patients with chronic obstructive pulmonary disease: a secondary analysis of data from two parallel randomised controlled trials. Lancet Respir Med 2015; 3: 435–442.
- Vestbo J, et al.: Fluticasone furoate and vilanterol and survival in chronic obstructive pulmonary disease with heightened cardiovascular risk (SUMMIT): a double-blind randomised controlled trial. Lancet 2016; 387: 1817–1826.
- Vogelmeier CF, et al.: Global Strategy for the Diagnosis, Management and Prevention of Chronic and Obstructive Lung Disease 2017 Report : GOLD Executive Summary. Eur Respir J 2017; 49: 1700214.
- Vestbo J, et al.: Single inhaler extrafine triple therapy versus long-acting muscarinic antagonist therapy for chronic obstructive pulmonary disease (TRINITY). Lancet 2017; 389: 1919–1929.
- Singh D, et al.: Single inhaler triple therapy versus inhaled corticosteroid plus long-acting β2-agonist therapy for chronic obstructive pulmonary disease (TRILOGY): a double-blind, parallel group, randomised controlled trial. Lancet 2016; 388: 936–973.
- Chong J, Leung B, Poole P, Black PN: Phosphodiesterase 4 inhibitors for chronic obstructive pulmonary disease. Cochrane Database Syst Rev 2011; (5): CD002309.
- Pavord ID, et al.: Mepolizumab for Eosinophilic Chronic Obstructive Pulmonary Disease. N Engl J Med 2017; 377: 1613–1629.
- LTOT Trial Research Group: A Randomized Trial of Long-Term Oxygen for COPD with Moderate Desaturation. N Engl J Med 2016; 375(17): 1617–1627.
- Leuppi JD, et al.: Short-term vs conventional glucocorticoid therapy in acute exacerbations of chronic obstructive pulmonary disease: the REDUCE randomized clinical trial. JAMA 2013; 309(21):2223–2231.
HAUSARZT PRAXIS 2018; 13(1): 41–43
Autoren
- Mirjam Peter, M.Sc.
Publikation
- HAUSARZT PRAXIS



Comments are closed.