Erster Schritt bei der Verordnung einer Inhalationstherapie ist die optimale Gerätewahl. Diese muss sich auf Patientenfaktoren (Kooperationsfähigkeit, erzielbarer Inspirationsfluss und Schweregrad der Obstruktion) und Kenntnis der physikalisch-technischen Gegebenheiten des Geräts stützen. Eine gute Instruktion und periodische Überprüfung der Inhalationstherapie ist wichtig. Bei COPD («Chronic Obstructive Pulmonary Disease») mit mittelschwerer bis schwerer Obstruktion ist für die Inhalationstherapie erste Wahl ein Kombipräparat LAMA/LABA, welches eine funktionelle Verbesserung und Reduktion der Exazerbationsrate bewirkt. Topische Steroide sollen nur bei klarer Indikation (Asthma-Komponente) oder unbefriedigendem Resultat unter LAMA/LABA bei FEV1 <50% in Form einer Trippeltherapie erwogen werden. Basistherapie des Asthma bronchiale stellt eine Kombination ICS/LABA mit Symptom-angepasster ICS-Dosis dar. Mit Symbicort ist auch eine Therapie nach SMART-Prinzip («Symbicort Maintenance and Reliever Therapy») möglich.
Nachdem über lange Zeit nur wenige Medikamente zur Therapie von Asthma bronchiale und COPD zur Verfügung standen, hat in wenigen Jahren die Zahl der Substanzen, Kombinationen und Darreichungsformen enorm zugenommen. Insbesondere in der Therapie der COPD ist eine derart rasante Entwicklung eingetreten, dass es für Nichtspezialisten schwierig ist, sich einen aktuellen Überblick zu verschaffen.
Wir sind daran gewöhnt, uns Gedanken über Medikamentenwahl, Dosierung und Verabreichungsintervalle sowie allfällige Interaktionen, zu machen. Bei der Inhalationstherapie muss zudem die optimale Verabreichungsform gewählt werden. Bekanntermassen ist die Therapieadhärenz bei Inhalationstherapien häufig schlecht; oft werden Anwendungsfehler gemacht, so dass die Behandlung nicht effektiv ist [1]. Dieser Umstand muss bei der Therapiewahl berücksichtigt werden.
Einfluss von Partikel- und Patienten-abhängigen Faktoren
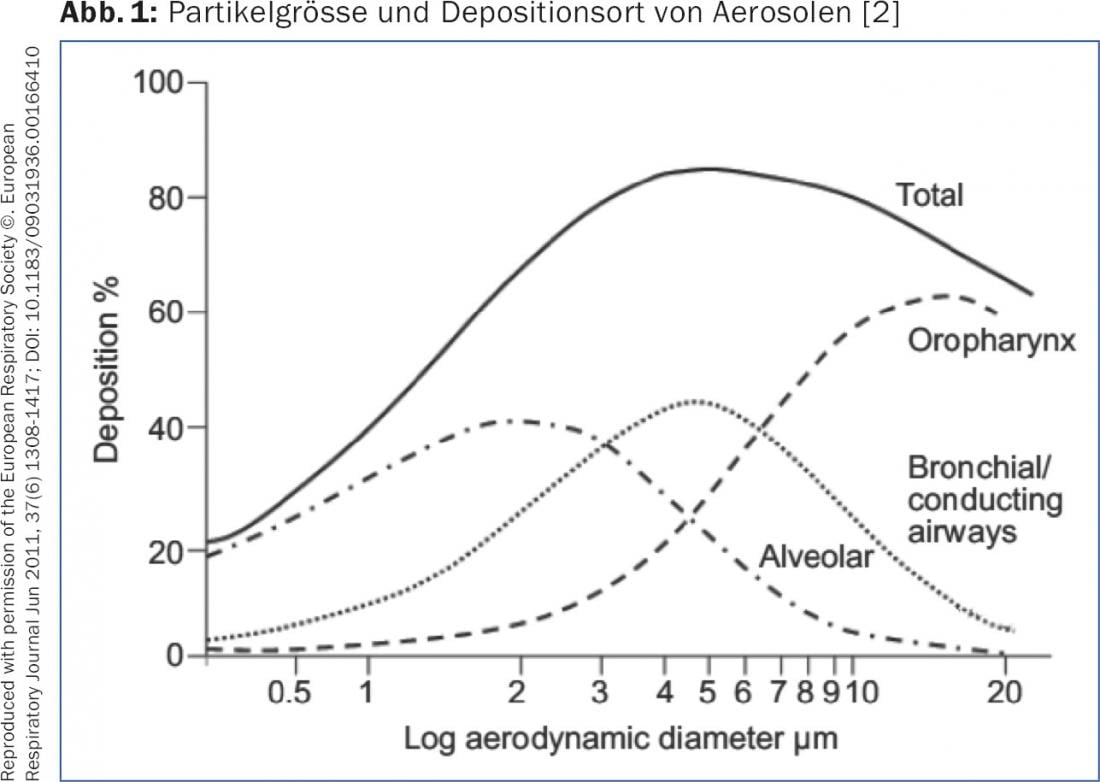
Die Deposition eines Aerosols in den Luftwegen wie auch der Partikel eines Pulverinhalators hängt von der Teilchengrösse («Mass Median Aerodynamic Diameter» [MMAD]) und dem Inspirationsfluss ab. Partikel mit einem MMAD von >5 μm erreichen nur in die zentralen und nicht, wie erwünscht, in die peripheren Luftwege. Teilchen mit einem MMAD von 1–5 μm, die sogenannte «Fine-Particle Fraction» (FPF), gelangen – wie für die Therapie mit Bronchodilatatoren oder topischen Steroiden erwünscht – in die mittleren und kleinen Atemwege und werden hier durch Sedimentation deponiert. Sehr kleine Teilchen mit einem MMAD von <1 μm gelangen durch Diffusion bis in die Alveolen oder werden wieder ausgeatmet (Abb. 1). Zur Gewährleistung einer guten Sedimentation der Partikel sollte am Ende der Inhalation der Atem für 5–10 Sek. angehalten werden. Um die Deposition eines Dosieraerosols (DA) mit oder ohne Vorschaltkammer zu optimieren, sollte beim Erwachsenen über 4–5 Sek. eingeatmet werden. Dies garantiert eine optimale Flussgeschwindigkeit von ca. 30 l/Min. Bei einem Pulverinhalator muss so tief und fest wie möglich inhaliert werden, um eine genügende FPF zu generieren. Innerhalb des Gerätes muss ein turbulenter Fluss entstehen, welcher die Partikel desaggregiert und die gewünschten feinen Partikel generiert [2,3]. Zusätzlich beeinflusst die vorliegende Lungenerkrankung die Aerosol-Deposition. Bei schwerer obstruktiver Ventilationsstörung oder «Mucus Plugging» werden deutlich weniger Partikel peripher deponiert. Bronchodilatatoren entwickeln ihre grösste Wirkung in den mittleren Luftwegen (sog. «Conducting Airways») während Kortikosteroide vermutlich besser uniform bis in die Peripherie verteilt werden, da die entzündlichen Veränderungen sich bis in die kleinsten Luftwege manifestieren.
Damit eine Inhalationstherapie wirksam ist muss sie nicht nur regelmässig, sondern auch technisch korrekt durchgeführt werden. Multiple Studien haben gezeigt, dass nur etwa 30% der Patienten ihr Dosieraerosol oder ihren Pulverinhalator optimal, weitere etwa 40% akzeptabel anwenden, etwa 30% aber mit ungenügender Technik [4,5]. Gute Instruktion und regelmässige Kontrolle der Inhalationstechnik sind wesentliche Faktoren für eine erfolgreiche Inhalationstherapie. Insbesondere ältere Patienten wenden ihre Inhalationsgeräte häufig trotz guter Instruktion nicht korrekt an. Die Wahl der Inhalationstherapie muss sich damit auch an den Fähigkeiten des Patienten orientieren. Falls möglich, sollten nicht verschiedene Systeme gleichzeitig verordnet werden. Die Verordnung von Kombinationspräparaten ist sinnvoll, um die Therapie zu vereinfachen. Wenn ein Patient die Anwendung eines Inhalationsgerätes beherrscht, sollte nicht ohne triftigen Grund auf ein anderes gewechselt werden.
Zur Verfügung stehende Inhalationsgeräte
Dosieraerosole (DA): DA sind seit den 1950er Jahren die populärste Art der Verabreichung. Der Behälter steht unter Druck, Medikament und Treibmittel liegen in flüssiger Form vor. Der früher als Treibgas verwendete Fluorchlorkohlenwasserstoff (FCKW) wurde seit dem Verbot in allen DA durch Hydrofluoroalkane (HFA) ersetzt. Im Vergleich zu den früheren FCKW-DA ist die Austrittsgeschwindigkeit bei HFA-DA etwas tiefer, das Kältegefühl (sog. Freon-Effekt) etwas geringer. Austrittsgeschwindigkeit und Kühleffekt können weiter verringert werden durch Hinzufügen von etwas Alkohol, wie das in Foradil®, Alvesco® und Qvar® der Fall ist. Die meisten DA liegen als Dispersion vor, sie müssen vor Gebrauch geschüttelt werden. Ausnahmen sind die topischen Steroide Alvesco®(Ciclesonid) und Qvar® (Beclomethasondiproprionat), bei denen das Medikament im Treibgas gelöst ist. Diese DA produzieren deutlich kleinere Partikel von nur 1,2 μm MMAD («Extra-Fine Particles») mit besserer peripherer Deposition bei deutlich geringerer Austrittsgeschwindigkeit. Bei Erstgebrauch und Nichtgebrauch über mehrere Tage sollten alle DA mit Versprühen von zwei Hüben in die Umgebung vorbereitet werden. Konventionelle DA sollen mit einer Vorschaltkammer verwendet werden, um das Problem der hohen Austrittsgeschwindigkeit und schwierigen Koordination zu beheben. Die pulmonale Deposition kann damit von 15 auf ca. 40% gesteigert werden. DA mit gelöstem Medikament erreichen auch ohne Vorschaltkammer eine sehr gute Deposition von bis zu 60%. Um die Koordinationsprobleme zu minimieren, ist der Einsatz einer Vorschaltkammer dennoch häufig empfehlenswert. Die früheren grossen Vorschaltkammern sind verschwunden, verwendet werden heute nur noch kleinere, antistatische Vorschaltkammern wie Aerochamber plus® oder Vortex®. Ventolin DA als Notfallmedikament für unterwegs kann als Kompromiss auch ohne Vorschaltkammer verwendet werden, nicht aber in der Praxis oder auf der Notfallstation wie zur Testung der Reversibilität bei der Spirometrie.
Pulverinhalatoren («Dry Powder Inhaler» [DPI]): In den letzten Jahren wurden mehrere DPI neu eingeführt. Alle erfordern einen von Produkt zu Produkt unterschiedlichen Inspirationsflow, um die Partikel zu generieren [6]. Dieser ist aber immer höher als bei einem DA. Die meisten Patienten sind in der Lage, einen genügenden Inspirationsfluss zu erzeugen. Bei schwerer Überblähung stellt eher die Fähigkeit ein genügendes Inspirationsvolumen zu erbringen, um die gesamte Medikamentenmenge zu inhalieren, ein Problem dar. Dies kann bei Kapselsystemen durch zweimaliges Inhalieren kompensiert werden. Ausserdem unterscheiden sich die DPI durch ihren Inhalationswiderstand. Ein hoher Widerstand erschwert zwar das Erreichen eines hohen Flows, die resultierende tiefere Inhalationsgeschwindigkeit führt aber zu einer homogeneren Deposition. Die Kapselsysteme Handyhaler® (für Spiriva) und Breezhaler® (für Onbrez®, Seebri®, Ultibro®) sind klein und handlich, das Einsetzen der Kapseln erfordert aber ein gewisses Geschick. Der Patient muss darauf hingewiesen werden, dass die Kapseln – wenn richtig eingesetzt – bei der Inhalation ein vibrierendes Geräusch entwickeln. Ein Vorteil ist, dass man bei diesen Systemen überprüfen kann, ob der Patient die gesamte Medikamentenmenge inhaliert hat (Kapseln öffnen beim Handyhaler®, durchsichtige Kapseln beim Breezhaler®). Neben den Kapselsystemen sind mehrere Multidosen-DPI erhältlich. Der Turbuhaler® (für Symbicort®, Pulmicort®, Bricanyl) ist seit Jahren etabliert, handlich und einfach, aber gerade bei älteren Patienten etwas anfällig auf Handhabungsfehler. In Kürze wird in der Schweiz Turbu+® erhältlich sein, ein elektronisches, App-basiertes Zubehör, das auf den Turbuhaler aufgesteckt wird und über ein Smartphone eine lückenlose Dokumentation der Inhalationstherapie ermöglicht. Der intuitive Discus® (für Serevent®, Axotide®, Seretide®) wird wohl zunehmend vom noch einfacher zu handhabenden Ellipta® (für Anoro®, Relvar®, Incruse®, Arnuity®) verdrängt, der beim Öffnen der Verschlusskappe automatisch geladen wird. Als einziger DPI garantiert der Gennuair® (für Eklira®) einen genügenden Inspirationsfluss, indem das Gerät erst bei Erreichen eines suffizienten Einatmungsflusses die Dosis freisetzt. DPI erzielen eine zufriedenstellende pulmonale Deposition von etwa 30%.
Soft Mist Inhaler: Seit kurzem steht auch in der Schweiz das Soft Mist Inhaler System Respimat® (für Spiolto®, Striverdi® und bald auch Spiriva®) zur Verfügung, ein handlicher Multidosen-Inhalator. Mithilfe eines Federmechanismus wird die Medikamentenlösung durch zwei Siliziumdüsen gepresst und ein sehr feines Aerosol erzeugt. Dieses zeichnet sich durch eine niedrige Austrittsgeschwindigkeit und eine sehr stabile Sprühwolke (bis 1,5 Sek.) aus. Ein Treibgas ist nicht nötig. Der Respimat® ermöglicht eine relativ langsame Inhalation und stellt geringere Anforderungen an die Koordination als die üblichen DA. Die Partikelgrösse ist im Gegensatz zu den DPI unabhängig vom Inspirationsfluss. Es wird eine sehr gute pulmonale Deposition von 40–50% der freigesetzten Dosis erreicht.
Feuchtinhalation: Die Verwendung eines Verneblergeräts soll sich heute auf Einzelfälle beschränken, falls mit oben aufgeführten Geräten kein befriedigendes Resultat erzielt werden kann sowie auf Notfallsituationen bei COPD und Asthma. Die Partikelgrösse wird durch den Verneblerkopf und den applizierten Fluss bestimmt. Es sollen nur Verneblerköpfe und Kompressoren kombiniert werden, die validiert wurden. Bei Verwendung von Druckluft ab einem Wandanschluss muss auf die für den Verneblerkopf optimale Flussrate (meist 6–8 l/Min.) geachtet werden. Vernebler mit einem Ventilsystem, welches den Verlust von Aerosol in die Umgebung verhindert (z.B. Pari LC Plus) erhöhen die verfügbare Medikamentendosis. Wenn immer möglich sollen Erwachsene mit einem Mundstück und nicht einer Gesichtsmaske inhalieren, um die unerwünschte Filterfunktion der Nase zu vermeiden. Für die Feuchtinhalation sind nur kurzwirksame Bronchodilatatoren und ein topisches Steroid (Pulmicort® Respules) erhältlich.
Medikamentenwahl
COPD: Ziel der Therapie bei der COPD ist eine Verbesserung der Lungenfunktion, insbesondere aber der körperlichen Leistungsfähigkeit und der Lebensqualität. Wesentlich ist auch die Verminderung der Exazerbationsrate. Exazerbationen der COPD sind ein prognostisch ungünstiger Faktor [7]. Sie sind Ursache kostspieliger Hospitalisationen, für die Patienten sehr belastend und die Lebensqualität massiv beeinträchtigend. Aus diesem Grund orientieren sich die heutigen Therapieempfehlungen nicht mehr allein am Schweregrad der Obstruktion, sondern an einer multidimensionalen COPD-Klassierung, welche sich auf den Schweregrad der Obstruktion, die Dyspnoe, gemessen mit dem einfachen «modified Medical Research Council Questionnaire» (mMRC) (Tab. 1) oder den COPD Assessment Test (CAT) stützt, welcher mit acht Fragen die Symptome der Erkrankung erfasst [8]. Der Test resultiert in einem Score von 0–40. Der CAT-Fragebogen ist in vielen Sprachen erhältlich und online abrufbar [9]. Der dritte ausschlaggebende Faktor ist die Häufigkeit der Exazerbationen, bis zu einer Exazerbation/Jahr ohne Hospitalisation ist tolerabel, Patienten mit ≥2 Exazerbationen oder einer Hospitalisation werden als unbefriedigend therapiert beurteilt. Aufgrund dieser Faktoren können die COPD-Patienten in vier Gruppen (A–D) eingeteilt werden, an denen sich die Therapie orientiert (Abb. 2).


Die Therapierichtlinien werden auf der Homepage der «Global Initiative for Obstructive Lung Disease» sowohl ausführlich, als auch in Kurzform dargestellt [10]. Eingesetzt werden folgende Medikamentenklassen: kurzwirksames Betamimetikum (SABA), langwirksames Betamimetikum (LABA), langwirksames Antimuskarinikum (LAMA) und topische Steroide (ICS) (Tab. 2 und 3).


Alle symptomatischen Patienten sollen ein kurzwirksames Betamimetikum (SABA) als Notfallmedikament erhalten. Für Patienten der Gruppe A ist dies ausreichend. Stärker symptomatische Patienten mit mässiger Obstruktion und ohne gehäufte Exazerbationen (Gruppe B) erhalten als erste Wahl ein LAMA. Falls der Effekt ungenügend ist oder der Patient ausgeprägt symptomatisch ist, kommt direkt ein Kombinationspräparat LAMA/LABA zum Einsatz. Multiple Studien haben gezeigt, dass die Kombination LAMA/LABA bzgl. Verbesserung der Lungenfunktion, der Leistungsfähigkeit sowie der Lebensqualität einer Monotherapie wie auch einer Kombinationstherapie LABA/ICS überlegen ist [11].
Die Bedeutung der ICS hat in den letzten Jahren klar abgenommen. Ihr Einsatz steht auf alle Fälle nur bei einem FEV1 <50 (–60)% des Solls und gehäuften Exazerbationen zur Diskussion. Alle grossen Studien mit ICS mussten als Negativeffekt eine leicht erhöhte Pneumonie-Rate verzeichnen. Bei Patienten der Gruppe C und D ist die Reduktion der Exazerbationsrate ein wichtiges Therapieziel. Die Kombination LABA/ICS vermag die Exazerbationsrate zu vermindern unter Inkaufnahme etwas häufigerer Pneumonien [12]. Aber nicht nur Steroide, auch LAMA und LABA haben einen günstigen Einfluss auf die Zahl der Exazerbationen. In einem Direktvergleich konnte gezeigt werden, dass die Kombination LAMA/LABA (Ultibro®) bzgl. Exazerbationsrate nicht nur gleichwertig, sondern der Kombination LABA/ICS (Seretide®) sogar überlegen war [13]. Damit empfiehlt sich sowohl bei Gruppe 3 wie 4 als erste Wahl eine Kombination LAMA/LABA. Eine ICS ist angezeigt, wenn sich neben der COPD klare Aspekte eines zusätzlichen Asthma bronchiale (hochgradige Reversibilität der Obstruktion, Asthma-Anamnese, Eosinophilie), ein sogenanntes «Asthma COPD Overlap Syndrom» (ACOS) zeigen oder bei Unverträglichkeit eines Bronchodilatators. Möglicherweise profitieren auch Patienten mit leicht vermehrten Bluteosinophilen (>200 oder 300/ μl) von den ICS. Bei schwerst symptomatischen Patienten der Gruppe D kann eine Tripeltherapie LAMA/LABA/ICS erwogen werden, selbstverständlich neben den nicht-inhalativen Therapiemassnahmen. Direktvergleiche innerhalb der Substanzklassen fehlen weitgehend, so dass keine klaren Präferenzen formuliert werden können.
Asthma bronchiale: Im Gegensatz zur Therapie der COPD hat sich die Behandlung des Asthma bronchiale in den letzten Jahren nicht wesentlich verändert. Ziel der Therapie sind eine optimale Symptomkontrolle, eine möglichst normalisierte Lungenfunktion und die Vermeidung von Exazerbationen [14,15]. Bewährt hat sich zur Erfassung der Symptomkontrolle ein Fragebogen wie der «Asthma-Control Test» (ACT) [16,17].
Jeder Asthmatiker erhält ein SABA als Notfallmedikament («Reliever»). Falls dieses nicht häufiger als 2×/Woche benötigt wird und die Therapieziele damit erreicht werden (GINA Stufe 1), ist keine weitere Medikation nötig. Ist dies nicht der Fall, kommen als Controller vorerst ICS in tiefer Dosierung (GINA Stufe 2) oder bei ausgeprägter Symptomatik, als Kombination ICS/LABA zum Einsatz (GINA Stufe 3) mit Dosissteigerung der ICS bei ungenügendem Effekt (GINA Stufe 4). Taktisch ist es meist geschickter, mit einer intensiven Therapie einzusteigen, um rasch eine gute Asthmakontrolle zu erzielen und dann die Therapieintensität zu reduzieren: vorerst wird die Dosis von ICS verringert und dann das LABA weggelassen («step-up/step-down»). Eine alternative Verordnungspraxis ab Stufe 3 ist das sog. SMART-Prinzip («Symbicort Maintenance and Reliever Therapy»), das nur mit einem LABA mit raschem Wirkungseintritt wie in Symbicort® (Formoterol/Budesonid) möglich ist. Dabei wird eine relativ tiefe Basisdosierung (Symbicort TH 200/6 2×1) verordnet, mit der Instruktion, zusätzliches Symbicort nach Bedarf zu inhalieren. Damit wird die ICS-Dosis automatisch dem aktuellen Bedarf angepasst, eine identische Asthmakontrolle ist mit einer meist moderaten Steroiddosis möglich. Das neue Kombipräparat Relvar® (Fluticasonfuroat/Vilanterol) erlaubt die Einmaldosierung. Das früher nur zur Therapie der COPD evaluierte Spiriva®, appliziert mit Respimat®, kann bei ungenügender Asthma-Kontrolle unter LABA/ICS als weitere inhalative Option (Off Label) hinzugefügt werden [18] (Tab. 4).

Literatur:
- Braido F, et al.: «Trying, But Failing» – The Role of Inhaler Technique and Mode of Delivery in Respiratory Medication Adherence. J Allerg Clin Immunol Pract 2016; 4: 823–832.
- Laube BL, et al.: What the pulmonary specialist should know about the new inhalation therapies. Eur Respir J 2011; 37: 1308–1331.
- Rothe T: Inhalative Therapie – Teil 1: Physik und Systeme. Schweiz Med Forum 2014; 14: 402–406.
- Crompton GK, et al.: The need to improve inhalation technique in Europe: a report by the Aerosol Drug Management Improvement Team. Respir Med 2006; 100: 1479–1494.
- Sanchis J, et al.: Systematic Review of Errors in Inhaler Use. Has Patient Technique Improved Over Time? CHEST 2016; 150(2): 394–406.
- Haidl P, et al.: Inhalation devices requirements for patient’s inhalation maneuvers. Respiratory Medicine 2016; 118: 65–75.
- Soler-Cataluna JJ, et al.: Severe acute exacerbations and mortality in patients with chronic obstructive pulmonary disease. Thorax 2005; 60: 925–931.
- Jones PW: COPD assessment test – rationale, development, validation and performance. J COPD 2013; 10(2): 269–271.
- www.catestonline.org
- www.goldcopd.org
- Vogelmeier CF, et al.: Efficacy and safety of once-daily QVA149 compared with twice-daily salmeterol-fluticasone in patients with chronic obstructive pulmonary disease (ILLUMINATE): a randomised, double-blind, parallel group study. Lancet Respir Med 2013; 1: 51–60.
- Calverley PMA, et al.: Salmeterol and Fluticasone Propionate and Survival in Chronic Obstructive Pulmonary Disease. N Engl J Med 2007; 356: 775–789.
- Wedzicha JA, et al.: Indacaterol-Glycopyrronium versus Salmeterol-Fluticasone for COPD. N Engl J Med 2016; 374: 2222–2234.
- www.ginasthma.org
- Reddel HK, et al.: A summary of the nex GINA startegy: a roadmap to asthma control. Eur Respi J 2015; 46: 622–639.
- Schatz M, et al.: Asthma Control Test: reliability, validity, and responsiveness in patients not previously followed by asthma specialists. J Allergy Clin Immunol 2006; 117: 549–556.
- www.asthmacontroltest.com/Europe/Switzerland/German
- Rodrigo GJ, et al.: What is the role of tiotropium in asthma?: a systematic review with meta-analysis. Chest 2015; 147: 388–396.
HAUSARZT PRAXIS 2016; 11(11): 24–30
Autoren
- Dr. med. Thomas Hess
Publikation
- HAUSARZT PRAXIS




Comments are closed.