Osteoporose ist ein weitreichendes Gesundheitsproblem, aber es gibt heutzutage eine Vielzahl an präventiven und therapeutischen Möglichkeiten. Für patientenadaptierte Vorbeugung und Behandlung sind Früherkennung und Risikostratifizierung wichtige Voraussetzungen. Die Schweizerische Vereinigung gegen Osteoporose hat 2020 ihre Empfehlungen zur Prävention, Diagnostik und Therapie aktualisiert.
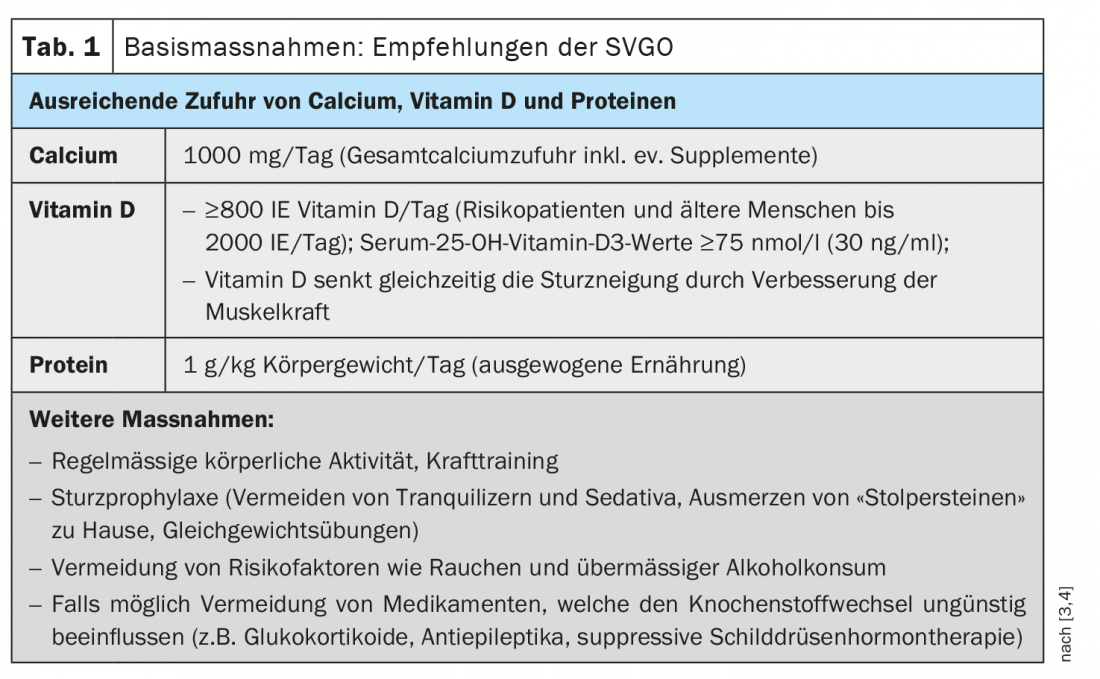
Mehrheitlich manifestiert sich Osteoporose bei Frauen nach dem 45. beziehungsweise bei Männern ab dem 55. Lebensjahr [1]. Sekundäre oder idiopathische Formen von Osteoporose bei jüngeren Personen sind selten. Dass Frauen von Osteoporose mehr als doppelt so häufig betroffen sind wie Männer ist vor allem auf die hormonellen Veränderungen nach der Menopause zurückzuführen, wobei epidemiologische Daten einen alterskorrelierten Anstieg der Prävalenz von 15% bei den 50–60-Jährigen auf 45% bei den über 70-Jährigen zeigen [2]. Je früher die Osteoporose erkannt wird, desto besser sind die Behandlungsmöglichkeiten. Neben Calcium und Vitamin D (Tab. 1) stehen heute zahlreiche sehr wirksame Osteoporose-Medikamente zur Verfügung, die mit ihren Wirkstoffen übermässigen Knochenabbau bremsen und/oder den Knochenaufbau gezielt fördern können (Tab. 2).
Risikostratifizierung als wichtige Grundlage für die Behandlung
In den 2020 aufdatierten Empfehlungen geht die Schweizerische Vereinigung gegen Osteoporose (SVGO) auf die Risikostratifizierung und darauf aufbauend auf die risikoadaptierte Therapie ein [3,4]. Der FRAX-Score ist aktuell das beste validierte Tool zur Erfassung von Risikofaktoren, das bei Männern und Frauen über 45 Jahren anwendbar ist. Es gibt auch einige Einschränkungen, so zum Beispiel, dass nur bei unbehandelten Patienten einsetzbar (Ausnahme: Gabe von Calcium und Vitamin D) und die Wirbelsäule nicht mitbeurteilt wird. Zur Diagnosesicherung einer Osteoporose dient die Knochendichtemessung (Densitometrie). FRAX und die Densitometrie (DXA) sind komplementäre diagnostische Massnahmen. Und auch wenn Östrogenmangel bei Frauen die wahrscheinlichste Ursache der Osteoporose respektive eines erhöhten Frakturrisikos ist, sollten differenzialdiagnostisch andere Ursachen ausgeschlossen werden.
Anamnese und FRAX: Anhand des FRAX (WHO Fracture Risk Assessment)-Algorithmus kann das absolute 10-Jahres-Risiko für schwere Frakturen von Hüfte, Wirbelsäule, Unterarm oder dem proximalen Humerus abgeschätzt werden [5,6]. Die Evaluation des FRAX-Scores basiert auf verschiedenen Risikofaktoren. Neben Alter und Geschlecht zählen dazu ein BMI <20, eine Fraktur nach dem 40. Lebensjahr (ausser Hände, Füsse, Schädel) sowie eine Oberschenkelhalsfraktur bei einem Elternteil. Im Weiteren stellen Rheumatoide Arthritis sowie aktuelle oder frühere orale Glukokortikoidtherapie über einen Zeitraum von mindestens 3 Monaten täglich (≥5 mg Prednisolonäquivalent) Risikofaktoren dar. Bezüglich Lebensstilfaktoren werden Rauchen und Alkoholkonsum von über drei Einheiten täglich genannt.
Densitometrie mittels Dual-X-ray-Absorptiometrie (DXA): Dieses bildgebende Verfahren soll eingesetzt werden, wenn klinische Risikofaktoren auf ein erhöhtes Osteoporoserisiko hinweisen. Eine DXA-Messung wird an der Lendenwirbelsäule (Mittelwert der beurteilbaren Wirbel L1–L4), am Gesamtfemur und am Femurhals (Einzelmessung oder Mittelwert aus Femur links und rechts) durchgeführt. Für die Abschätzung des 10-Jahres-Frakturrisikos ist der niedrigste Wert von LWS, Femurhals und Gesamtfemur massgebend. Das Ergebnis der DXA-Messung wird als T-Score angegeben und zeigt in Form von Standardabweichungen an, wie gross die Abweichungen der gemessenen Knochendichte von der Knochendichte junger gesunder Erwachsener ist. Bei einem Wert von –1 bis –2,5 handelt es sich um eine Vorstufe einer Osteoporose, bei einem Wert unter –2,5 um eine Osteoporose [7].
Neue Zuordnung der Frakturrisikogruppe: Es werden neuerdings die folgenden fünf Frakturrisikogruppen unterschieden:
1. Unmittelbare Frakturgefahr (imminent), d.h. >10% Frakturrisiko innerhalb der nächsten 2 Jahre: Alter 65+ und osteoporotische Fraktur (Wirbelkörper, Hüfte, Humerus, Radius, Becken) während der zurückliegenden 2 Jahre
2. Sehr hohes Frakturrisiko: Das 10-Jahres-Frakturrisiko für eine osteoporotische Fraktur (Wirbelkörper, Hüfte, Humerus, Radius, Becken) gemäss FRAX liegt mindestens 20% über der Interventionsschwelle.
3. Hohes Frakturrisiko: Osteoporotische Fraktur (Wirbelkörper, Hüfte, Humerus, Radius, Becken) vor mehr als 2 Jahren und/oder das 10-Jahres-Frakturrisiko für eine osteoporotische Fraktur (Wirbelkörper, Hüfte, Humerus, Radius, Becken) gemäss FRAX liegt höher als die Interventionsschwelle, aber weniger als 20% darüber. In diese Gruppe fallen auch Personen unter Dauertherapie mit Glukokortikoiden, Aromatasehemmern (Frau) oder Androgensuppressiva (Mann), deren DXA-T-Wert <1,5 ist und/oder bei denen das 10-Jahres-Frakturrisiko für eine osteoporotische Fraktur (Wirbelkörper, Hüfte, Humerus, Radius, Becken) gemäss FRAX oberhalb der Interventionsschwelle liegt.
4. Moderates Frakturrisiko: DXA-T-Wert ≤ −2,5 und keine früheren Frakturen und 10-Jahres-Frakturrisiko für eine osteoporotische Fraktur (Wirbelkörper, Hüfte, Humerus, Radius, Becken) gemäss FRAX unterhalb der Interventionsschwelle.
5. Niedriges Frakturrisiko: Osteopenie und keine weiteren Risikofaktoren
Therapeutische Massnahmen basieren auf dem Frakturrisiko
Die Festlegung der passenden Behandlungsstrategie erfolgt bezugnehmend auf die Frakturrisikogruppe, sofern andere Ursachen der Osteoporose respektive des erhöhten Frakturrisikos ausgeschlossen wurden. Die Umsetzung der Basismassnahmen (Tab. 1) wird für jede Risikogruppe empfohlen. Für die spezifische Therapie stehen verschiedene Substanzklassen zur Verfügung(Tab. 2). In den Empfehlungen der SVGO wird folgendes Vorgehen vorgeschlagen, wobei darauf hingewiesen wird, die jeweiligen Kontraindikationen zu berücksichtigen.
Sehr hohes/imminentes Frakturrisiko bei Zustand nach vertebraler Fraktur: Teriparatid für 18–24 Monate, gefolgt von einer Erhaltungstherapie mit Bisphosphonaten oder Denosumab
Sehr hohes/imminentes Frakturrisiko bei Zustand nach Hüftfraktur: Bisphosphonat Zoledronat (Alternative: Denosumab)
Sehr hohes/imminentes Frakturrisiko bei Zustand nach jedweder osteoporotischen Fraktur an Wirbelkörper, Hüfte, Humerus, Radius oder Becken: Romosozumab für ein Jahr (Zurückhaltung bei erhöhtem kardiovaskulärem Erkrankungsrisiko), gefolgt von Bisphosphonaten oder Denosumab
Hohes Frakturrisiko: Bisphosphonate oder Denosumab (Alternative: Teriparatid bei Zustand nach vertebraler Fraktur oder T Wert < −3,5 SD an der Wirbelsäule)
Moderates Risiko: Hormonersatztherapie, Selektive Östrogenrezeptormodulatoren, evtl. orale Bisphosphonate, falls Knochenstoffwechselmarker (CTX, PINP) oberhalb des prämenopausalen Referenzbereichs liegen
Niedriges Risiko: evtl. Hormonersatztherapie (HRT) bei klimakterischem Syndrom.
Verlaufskontrolle ist ein sehr wichtiger Faktor. Eine Verlaufskontrolle mittels Densitometrie/DXA sollte jeweils nach 2 Jahren erfolgen, mit Ausnahme der niedrigen Risikogruppe (DXA erst nach 5–10 Jahren).
Wie können Rebound-Effekte vermieden werden?
Denosumab (Prolia®) und Romosozumab (Evenity®) sind beides sehr wirksame osteologische Biologika (Osteologica), können aber nach dem Absetzen zu einem Verlust der gewonnenen Knochenmasse führen, einem sogenannten «Rebound»-Effekt [8,9]. Nach Absetzen von Prolia®empfehlen sich zur Nachbehandlung Bisphosphonate wie Zoledronat (z.B. Aclasta®) oder Alendronat (z.B. Fosamax®) [11]. Gemäss derzeitigem Kenntnisstand kann ein Rebound am effizientesten abgefangen werden durch Zoledronat (Aclasta®) i.v. 5 mg 1× pro Jahr, erste Gabe 6 Monate nach letzter Prolia®-Applikation, alternativ kann Aledronat eingesetzt werden [8,10]. Zur Kontrolle der Nachbehandlung sind die Knochenumbaumarker alle drei bis sechs Monate zu messen [11]. Ein direkter Wechsel von Prolia® auf eine osteoanabole Therapie wie Teriparatid (z.B. Forsteo®) sollte vermieden werden, da sich dadurch der Rebound-Effekt verstärkt [8]. Eine Kombination von Prolia®und Forsteo® hat einen additiven Effekt, die Kombinatin von Biphosphonaten und Prolia® wird hingegen nicht empfohlen [8,12].
Romosozumab (Evenity®) ist in der Schweiz seit 2020 zugelassen für die Therapie schwerer Osteoporosen bei Frauen, die nach der Menopause ein deutlich erhöhtes Risiko für Knochenbrüche zeigen [9]. Die Applikation erfolgt 1× monatlich, maximale Therapiedauer beträgt 12 Monate, anschliessend ist eine Biphoshonattherapie erforderlich. Kontraindikationen für eine Romosozumabtherapie sind Schlaganfall oder Herzinfarkt in der Vorgeschichte [8].
Literatur:
- OsteoSwiss, www.osteoswiss.ch (letzter Abruf 16.03.2021)
- Gourlay ML, et al: Bone-density testing interval and transition to osteoporosis in older women. N Engl J Med 2012; 19; 366(3): 225–233.
- Ferrari S, Lippuner K, Lamy O, Meier C: 2020 recommendations for osteoporosis treatment according to fracture risk from the Swiss Association against Osteoporosis (SVGO). Swiss Med Wkly 2020, 150:w20352
- Stute P, Meier C: Update Osteoporose. J Gynäkol Endokrinol 2021, https://doi.org/10.1007/s41975-021-00181-4
- FRAX® Fracture Risk Assessment Tool, www.shef.ac.uk/FRAX (letzter Abruf 16.03.2021)
- Kanis JA, et al.: Assessment of fracture risk. Osteoporos Int 2005; 16(6): 581–589.
- «Osteoporose: Knochenschwund früh erkennen», 17.10.2020, https://nachrichten.idw-online.de, (letzter Abruf 16.03.2021)
- Mollet S: Osteoporose – ein Update, Dr. med. Stella Mollet, Forum für medizinische Fortbildung, 26.06.2020.
- Swissmedic: Arzneimittelinformation, www.swissmedicinfo.ch (letzter Abruf 16.03.2021)
- Anastasilakis AD, et al.: Zoledronate for the Prevention of Bone Loss in Women Discontinuing Denosumab Treatment. A Prospective 2-Year Clinical Trial. J Bone Miner Res 2019; 34(12): 2220–2228.
- «Prolia® und Evenity®: Wie den Rebound verhindern?», 28.01.2021, www.rheumaliga.ch/blog/2021/prolia-evenity-rebound-effekt
- Leder BZ, et al.: Response to Therapy With Teriparatide, Denosumab, or Both in Postmenopausal Women in the DATA (Denosumab and Teriparatide Administration) Study Randomized Controlled Trial. J Clin Densitom 2016; 19(3): 346–351.
HAUSARZT PRAXIS 2021; 16(4): 22–23
Autoren
- Mirjam Peter, M.Sc.
Publikation
- HAUSARZT PRAXIS




Comments are closed.