Sichtbare pruriginöse Läsionen an der Kopfhaut sind für viele Psoriasispatienten ein grosser Belastungsfaktor. Als Erstlinientherapie werden topische Präparate eingesetzt, welche aber insbesondere bei moderat bis schwer ausgeprägten Symptomen nicht immer zielführend sind. In diesen Fällen stellt eine wirksame und verträgliche Systemtherapie eine wichtige Behandlungsalternative dar. Apremilast ist eine der evidenzbasierten Therapieoptionen.
Juckreiz und Stigmatisierung gehen bei Patienten mit Psoriasis capitis häufig mit einer deutlich eingeschränkten Lebensqualität einher. Während bei leicht ausgeprägten Symptomen eine topische Behandlung ausreichend sein kann, trifft dies auf mittelgradig bis schwere Psoriasisläsionen oft nicht zu. Deshalb ist es wichtig, dass für diese Patientenpopulation evidenzbasierte systemische Behandlungsalternativen zur Verfügung stehen. Dazu zählt unter anderem der Phosphodiesterase-4-(PDE-4) Inhibitor Apremilast (Otezla®). Das zu den niedermolekularen Substanzen zählende Antipsoriatikum ist in oraler Darreichungsform erhältlich und hat sich zur Behandlung von Patienten mit Plaque-Psoriasis bereits mehrfach als wirksam erwiesen, einschliesslich bei Subpopulationen von Patienten mit einer Kopfhautbeteiligung. Dies zeigen Analysen der Phase-III-Studie ESTEEM 1 und 2 sowie die placebokontrollierte Studie LIBERATE, in welcher Apremilast mit Etanercept verglichen worden war [1–3]. Bei der Studie STYLE handelt es sich um die erste prospektive randomisierte placebokontrollierte Studie zur Untersuchung der Wirksamkeit und Sicherheit von Apremilast bei Patienten mit moderater bis schwerer Kopfhautpsoriasis. Die Resultate wurden im vergangenenen Jahr im Journal of the American Academy of Dermatology publiziert [4].
Hoher Anteil der Patienten erreichte Erscheinungsfreiheit
Um die Wirksamkeit und Sicherheit von Apremilast 30 mg (2×/d) für moderate bis schwere Psoriasis capitis zu untersuchen, wurde eine doppelblinde, placebokontrollierte Phase III-Studie durchgeführt bei Erwachsenen mit moderater bis schwerer Kopfhautpsoriasis, welche ein ungenügendes Ansprechen gezeigt hatten auf mindestens eine topische Psoriasisbehandlung. Der primäre Endpunkt war der Anteil an Patienten, welche im «Scalp Physician Global Assessment» einen Score von 0 (erscheinungsfrei) oder 1 (fast erscheinungsfrei) erreichten mit einer Reduktion um mindestens 2 Punkte 16 Wochen nach Baseline. Sekundäre Endpunkte waren eine Verbesserung um mindestens 4 Punkte bezüglich Juckreiz insgesamt («Whole Body Itch») und Pruritus im Bereich der Kopfhaut («Scalp Itch Numeric Rating Scales», NRS), sowie eine verbesserte Lebensqualität («Dermatology Life Quality Index», DLQI). Insgesamt wurden 303 Patienten auf die Studienarme Apremilast (n=201) oder Placebo (n=102) randomisiert. Unter Apremilast erreichten signifikant mehr Patienten die Endpunkte hinsichtlich Scalp Physician Global Assessment (43,3% vs. 13,7%), Scalp Itch NRS (47,1% vs. 21,1%) und Whole Body Itch NRS (45,5% vs. 22,5%).
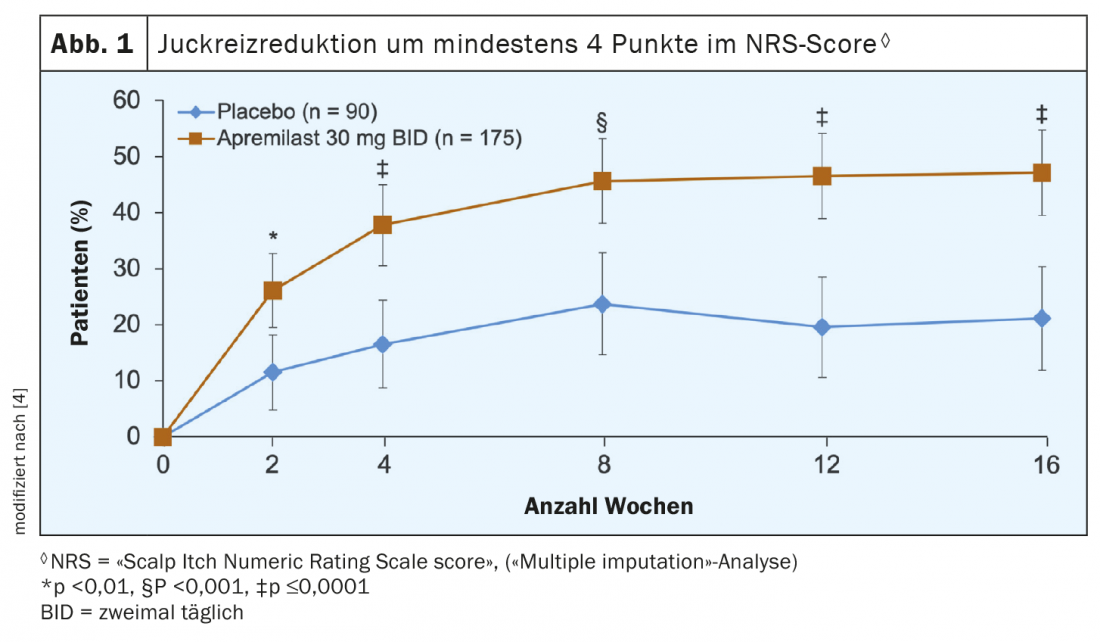
Juckreizreduktion und Verbesserung der Lebensqualität als wichtige Outcomes
Zur Bewertung des Pruritus beurteilten die Patienten Juckreizsymptome im Bereich der Kopfhaut anhand des Messinstrumentes NRS («Scalp Itch Numeric Rating Scales») auf einer Skala von 0 (kein Juckreiz) bis 10 (Juckreiz in der stärksten vorstellbaren Intensität). In Abbildung 1 sind die Datenauswertungen ersichtlich, welche zeigen, dass die Apremilastbehandlung in einer nachweislich geringeren Juckreizbelastung im Bereich der Kopfhaut resultierte. So erreichte bei allen Messzeitpunkten bis und mit Woche 16 nach Baseline ein signifikant höherer Anteil an Patienten der Apremilastgruppe eine Verbesserung um mindestens 4 Punkte im NRS-Score. Es handelt sich hierbei um ein bedeutsames Target, denn chronischer Juckreiz kann kann ähnlich wie chronische Schmerzen die Lebensqualität erheblich beeinträchtigen und führt in gewissen Fällen zu Schlafmangel, Leistungsminderung und depressiven Störungen. Dass die Patienten auch hinsichtlich Lebensqualität von der Apremilastbehandlung profitierten, zeigt ein Blick auf Ausprägungen im «Dermatology Life Quality Index» (DLQI). In der Verumgruppe zeigte sich eine signifikant stärkere Verbesserung der Least-Squares-Mittelwerte (LSM) verglichen mit Placebo (–6,7 vs. –3,8; p<0,0001). LSM sind Mittelwerte, bei welchen der Einfluss von Kovariaten auf die abhängige Variable herausgerechnet wurde.
Insgesamt war die Behandlung gut verträglich, zu gelegentlichen Nebenwirkungen unter Apremilast zählten Diarrhoe, Nausea und Kopfschmerzen.
Literatur:
- Papp K, et al.: Apremilast, an oral phosphodiesterase 4 (PDE4) inhibitor, in patients with moderate to severe plaque psoriasis: results of a phase III, randomized, controlled trial (Efficacy and Safety Trial Evaluating the Effects of Apremilast in Psoriasis [ESTEEM 1]). J Am Acad Dermatol. 2015; 73: 37–49.
- Paul C, et al.: Efficacy and safety of apremilast, an oral phosphodiesterase 4 inhibitor, in patients with moderate to severe plaque psoriasis over 52 weeks: a phase III, randomized, controlled trial (ESTEEM 2). Br J Dermatol. 2015; 173: 1387–1399.
- Reich K, et al.: The efficacy and safety of apremilast, etanercept, and placebo, in patients with moderate to severe plaque psoriasis: 52-week results from a phase 3b, randomized, placebo-controlled trial (LIBERATE). J Eur Acad Dermatol Venereol. 2017; 31: 507–517.
- Van Voorhees AS, et al.: Efficacy and safety of apremilast in patients with moderate to severe plaque psoriasis of the scalp: Results of a phase 3b, multicenter, randomized, placebo-controlled, double-blind study. JAAD 2020; 83(1): 96–103.
DERMATOLOGIE PRAXIS 2021; 31(2): 34
Autoren
- Mirjam Peter, M.Sc.
Publikation
- DERMATOLOGIE PRAXIS



Comments are closed.