Ein übergeordnetes Prinzip für die Therapiewahl bei Psoriasis-Arthritis ist die gemeinsame Entscheidungsfindung mit den Patienten. Die GRAPPA-Empfehlungen schlagen einen individualisierten Behandlungsansatz vor, welcher die vorherrschenden Krankheitsdomänen gemäss Caspar-Klassifikation berücksichtigt, aber auch Komorbiditäten und Patientenpräferenzen miteinbezieht.
Wenn Psoriasispatienten von Gelenkschmerzen («Pain»), Steifheit («Stiffness») und Rückenschmerzen («Axial involvement») berichten, die sich mit körperlicher Aktivität verbessern, sollte man als Dermatologe an eine Psoriasis-Arthritis denken [1]. Bei bis zu einem Drittel der Patienten mit Plaque-Psoriasis entwickelt sich im Verlauf der Erkrankung eine entzündliche Beteiligung von Enthesen und Gelenken, die zu den Spondylarthritiden (SpA) gehören und unter dem Sammelbegriff Psoriasis-Arthritis (PsA) zusammengefasst werden [2]. Die PsA zählt zu den peripheren SpA, während den axialen SpA unter anderem die ankylosierende Spondylitis zugerechnet wird [3]. Charakteristisch bei PsA sind Schwellungen und Druckschmerzhaftigkeit im Bereich der Gelenke. Neben einer strahlenförmigen Verdickung einzelner Finger oder Zehen (Daktylitis) können Schmerzen im Bereich von Sehneninsertionen auftreten (Enthesitis) [4]. Hilfreich für die Diagnosestellung ist die Caspar-Klassifikation («Classification Criteria for Psoriatic Arthritis»). Dieses diagnostische Tool erfasst unter anderem Sakroilitis, Enthesitis, Daktylitis und Nagelbefall [10]. Diese Einteilung liegt den Behandlungsempfehlungen der GRAPPA* zugrunde.
* GRAPPA=Group for Research and Assessment of Psoriasis and Psoriatic Arthritis
Domänenspezifischer Behandlungsansatz empfohlen
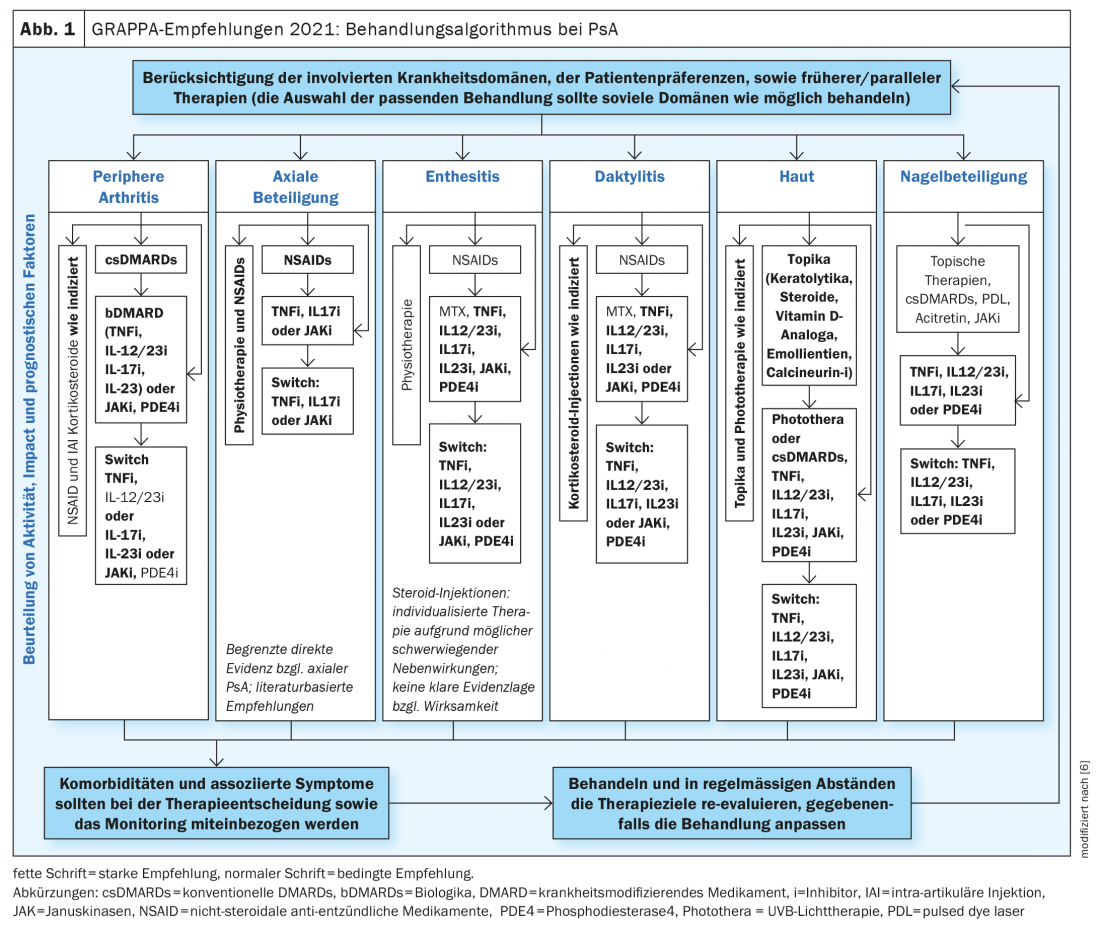
Es gibt heutzutage ein breites Spektrum an Behandlungsmöglichkeiten für PsA. Bei ungenügendem Ansprechen auf konventionelle Systemtherapeutika (csDMARDs) kommen Biologika (bDMARDs) oder «Small Molecules» (tsDMARDs) zum Einsatz. Dr. med. Joseph Merola, Dermatologe und Rheumatologe, Harvard Medical School, Boston (USA), referierte anlässlich der Jahrestagung des EADV über Kriterien zur Auswahl der individuell passenden Behandlung von Patienten mit PsA [5]. Gemäss aktueller Experteneinschätzung, einschliesslich der GRAPPA-Empfehlungen zu Diagnostik und Behandlung von Pso und PsoA, wird ein domänenspezifischer Ansatz propagiert (Abb. 1), bei welchem berücksichtigt wird, welche der folgenden Krankheitsdomänen vorherrschend sind: periphere Artrhitis, axiale Beteiligung, Enthesistis, Daktylitis, Hautpsoriasis, Nagelbeteiligung [5,6].
| Die Rolle proinflammatorischer Zytokine in der PsA-PathogenesePsA-Patienten weisen mehrheitlich zunächst psoriatische Hauterscheinungen auf, bevor nach durchschnittlich zehn Jahren eine Gelenkbeteiligung diagnostiziert wird [7]. Das typische Manifestationsalter der PsA liegt bei 35–50 Jahren [8]. Pathophysiologisch resultieren prädisponierende genetische Faktoren in fehlgesteuerten immunologischen Prozessen, wodurch es zu einer Überexpression von proinflammatorischen Zytokinen (z.B. TNF, IL-17, IL-23 und IL-6) kommt. Diese bewirken eine zytokinvermittelte Invasion verschiedenster Immunzellen am Entzündungsort, die ihrerseits weitere Zytokine sezernieren und so die inflammatorische Reaktion verstärken und aufrechterhalten [7,8]. Im Zusammenhang mit diesen Prozessen kommt es zu einer gesteigerten Entzündungsreaktion in der inneren Schicht der Gelenkkapseln (Synovitis), die zu einer Schädigung des Gelenkknorpels sowie zu einer Knochenerosion führt [8]. Die verschiedenen Zytokine, die im Zuge der Entzündungsreaktion sezerniert werden, spielen für die unterschiedlichen Krankheitsmanifestationen der PsA eine Rolle und stellen mögliche therapeutische Targets dar. Das Therapieziel ist in erster Linie eine Reduktion der radiologischen Progression und Entzündung. Eine starke Beteiligung der Gelenke spricht für den frühen Einsatz von DMARDs. Dank modernster Therapien ist Remission heute ein erreichbares Behandlungsziel bei PsA [9]. |
Bei peripherer Arthritis sind die meisten zur Verfügung stehenden Medikamente ähnlich wirksam. Dementsprechend kommen bei ungenügendem Ansprechen auf konventionelle krankheitsmodifizierende Medikamente (csDMARDs) sowohl Biologika, als auch JAK-Inhibitoren und Phosphodiesterase-4-(PDE-4-)Hemmer infrage. Insbesondere für TNF-alpha-Hemmer sowie mehrere Interleukininhibitoren (IL-12/23-i, IL-17-i und IL-23-i) gibt es eine gute Evidenzbasis.
Bei PsA-Patienten mit axialer Arthritis haben sich neben nichtsteroidalen anti-entzündlichen Medikamenten (NSAIDs) und Physiotherapie vor allem TNF-alpha-Hemmer und IL-17-Hemmer sowie JAK-Hemmer bewährt. Ungenügend ist die Datenlage nach Einschätzung der GRAPPA aktuell für IL-12/23- und IL-23-Hemmer.
Bei PsA-Patienten mit Enthesitis und Daktylitis gibt es die besten Evidenzen für TNF-alpha-i sowie IL-12/23-i, IL-17-i und IL-23-i.
Bei Nagelpsoriasis werden die besten Ergebnisse mit TNF-alpha-Hemmern, IL-12/23-i, IL-17-i und IL-23-i sowie mit PDE-4-Hemmern erzielt.
Auch Komorbiditäten wie chronisch-entzündliche Darmerkrankung (CED) oder Uveitis sind in die Therapieentscheidung miteinzubeziehen. Liegt bei einem PsA-Patient als Begleiterkrankung eine CED vor, wird bevorzugt zum Einsatz von TNF-alpha-Hemmern (ausser Etanercept), IL-12/23-i und JAK-i geraten. Bei komorbider Uveitis stehen TNF-alpha-Hemmer (mit Ausnahme von Etanercept) an erster Stelle. Nicht zuletzt sind neben den vorherrschenden Krankheitsdomänen und Komorbiditäten auch Patientenpräferenzen bezüglich Applikationsform (oral vs. subkutan) und Behandlungsintervall zu berücksichtigen bei der Auswahl der passenden Systemtherapie.
Kongress: EADV Annual Meeting
Literatur:
- Gottlieb A, et al.: Psoriatic arthritis for dermatologists. J Dermatolog Treat 2020; 31(7): 662–679.
- Sticherling M: Einsatz von Secukinumab bei Patienten mit Psoriasis und Psoriasis-Arthritis – Ergebnisse einer nichtinterventionellen Studie unter Praxisbedingungen (SERENA-Studie). Kompass Autoimmun 2021; 3: 118–120.
- Proft F, Poddubnyy D: Ankylosing spondylitis and axial spondyloarthritis: recent insights and impact of new classification criteria. Ther Adv Musculoskelet Dis 2018; 10(5–6): 129–139.
- Borst C: Psoriasisarthritis. hautnah 2020; 19: 146–151.
- Merola JF: Personalized Care in Psoriatic Arthritis, Dr. med. Joseph Merola, EADV Annual Meeting, EADV Annual Meeting, 29.09.21–02.10.21.
- Coates LC et al. The Group for Research and Assessment of Psoriasis and Psoriatic Arthritis (GRAPPA) Treatment Recommendations 2021, eEULAR 2021, Abstract OP0229, http://dx.doi.org/10.1136/annrheumdis-2021-eular.4091
- Ritchlin CT, Colbert RA, Gladman DD: Psoriatic Arthritis. N Engl J Med 2017; 376(10): 957–970.
- Veale DJ, Fearon U: The pathogenesis of psoriatic arthritis. Lancet. 2018; 391(10136): 2273–2284.
- Tucker LJ, Ye W, Coates LC: Neue Ansätze beim Management der Psoriasis-Arthritis: Können wir zielgerichtet behandeln? Karger Kompass Autoimmun 2019; 1: 8–16
- Tillett W, et al.: The ClASsification for Psoriatic ARthritis (CASPAR) criteria – a retrospective feasibility, sensitivity, and specificity study. J Rheumatol 2012; 39(1): 154–156.
- Creakyjoints.org, https://creakyjoints.org (letzter Abruf 19.11.2021)
DERMATOLOGIE PRAXIS 2021; 31(6): 20–21
Autoren
- Mirjam Peter, M.Sc.
Publikation
- DERMATOLOGIE PRAXIS




Comments are closed.