Bis zu 30 Prozent der von einer Psoriasis vulgaris Betroffenen weisen zusätzlich eine Arthritis auf. Die Therapie der Psoriasisarthritis richtet sich nach der Manifestationsart. Hierbei stehen diverse immunmodulierende Substanzen zur Verfügung, die stufenweise eingesetzt werden.
Die Psoriasisarthritis (PsA) kann durch ihre fortschreitende und destruktive Natur zu erheblichen Einschränkungen von Funktion und Lebensqualität führen. 1964 wurde PsA von der American Rheumatism Association als eigene Erkrankung anerkannt.
20–30% der von einer Psoriasis vulgaris betroffenen Patienten weisen zusätzlich eine Arthritis auf. Die Inzidenz liegt bei etwa 3–8/100’000 [1]. Meist tritt die PsA während oder nach dem kutanen Befall auf. Sie kann sich aber auch vor der kutanen Psoriasis oder gar ohne Psoriasis (sine psoriase) manifestieren. In diesem Fall wird sie aufgrund des Befallsmusters und der typischen radiologischen Veränderungen diagnostiziert. Der Schweregrad der kutanen Psoriasis korreliert nicht mit dem Gelenksbefall.
Klinik
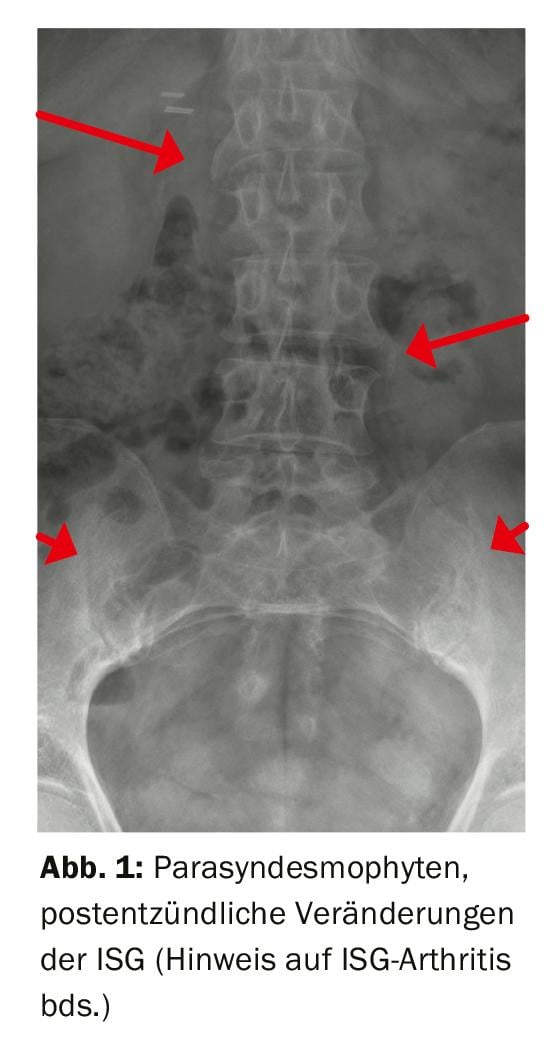
Das Bild der PsA ist sehr heterogen und wird von Moll und Wright [2] in fünf Formen eingeteilt, variierend von einer symmetrischen Polyarthritis, einer asymmetrischen Oligoarthritis mit Befall weniger Gelenke, bis hin zur seltenen mutilierenden Arthritis. Ein isolierter Befall der distalen Interphalangealgelenke (DIP), häufig einhergehend mit einem psoriatischen Befall der Nägel, oder ein Strahlbefall, bei dem MCP, PIP und DIP einzelner Finger oder Zehen betroffen sind, ist besonders typisch und gut von einer differenzialdiagnostisch in Betracht zu ziehenden rheumatoiden Arthritis zu unterscheiden. Allerdings kann bei Transversalbefall der DIP-Gelenke die Abgrenzung zur Fingerpolyarthrose (Heberden-Arthrose) schwierig sein. Bei 20% der Patienten wird ein axialer Befall nachgewiesen, oft eine einseitige Arthritis eines Iliosakralgelenks oder eine Spondylitis (Abb. 1), was die Zuordnung der PsA zum Formenkreis der Spondyloarthritiden erklärt. Weitere typische muskuloskelettale Krankheitsmanifestationen bei PsA sind Enthesitiden (Entzündungen von Sehnen- und Bänderansätzen) und Daktylitiden (wurstartige Entzündungen von einzelnen Fingern oder Zehen). Als extraartikuläre Manifestationen gelten Uveitiden sowie ein entzündlicher Darmbefall. Mehr als die Hälfte der Patienten mit einer PsA sind von mindestens einer Komorbidität betroffen, am häufigsten von kardiovaskulären Erkrankungen, metabolischem Syndrom sowie Depression und Angststörungen. Die systemische Entzündung führt, vermittelt über inflammatorische Zellen und Zytokine inklusive TNFα, via leichtgradiger Gefässentzündung zu einer verfrühten Atherosklerose. Weitere assoziierte Erkrankungen sind unter anderem die Osteoporose und die Lebersteatose [3].
Die PsA ist mit komplexen Genotypen assoziiert, wobei die genetische Prädisposition bei der PsA stärker ist als bei der Psoriasis vulgaris. Trigger der Erkrankung können Umweltfaktoren (insb. Rauchen), Stress, Übergewicht oder Trauma sein. Letzteres ist bei der Psoriasis vulgaris als Köbner-Phänomen bekannt. Gemäss einer Studie geht bei fast 25% der Patienten ein lokales Trauma der Entwicklung einer Psoriasisarthritis voraus [4]. Bei der Pathogenese der Psoriasisarthritis spielt die IL23/IL17-Achse eine wichtige Rolle, bei der Typ17-T-Helferzellen via Induktion von IL23 proinflammatorische Zytokine produzieren.
Diagnostik
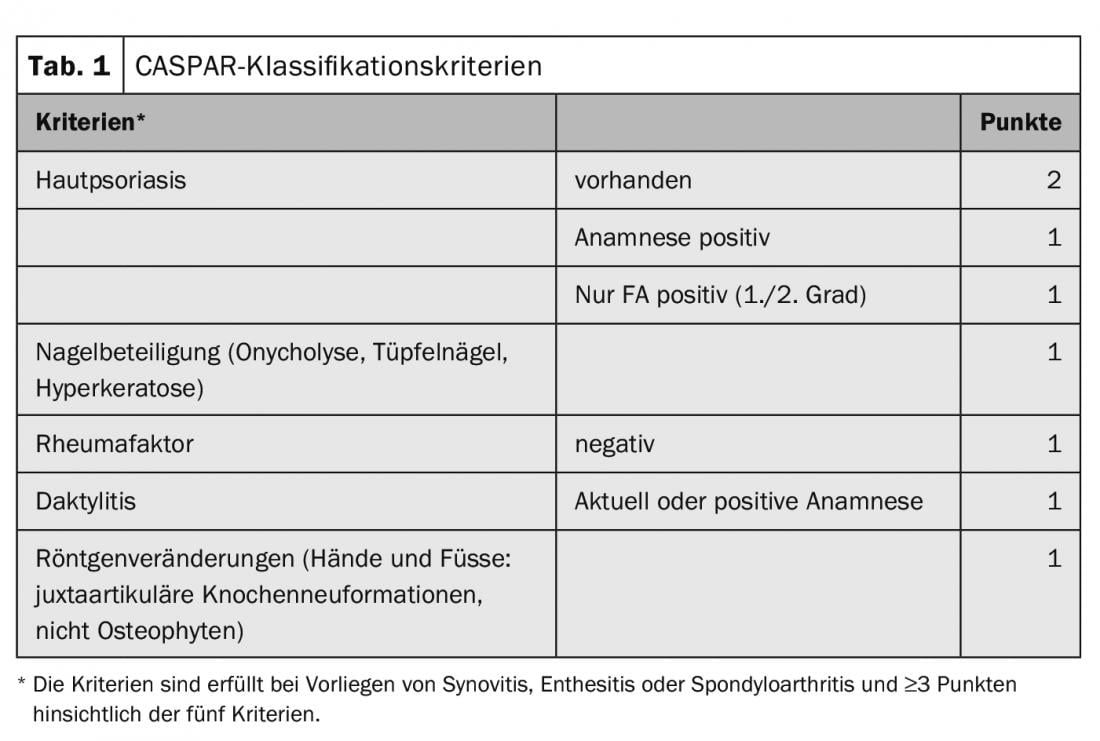
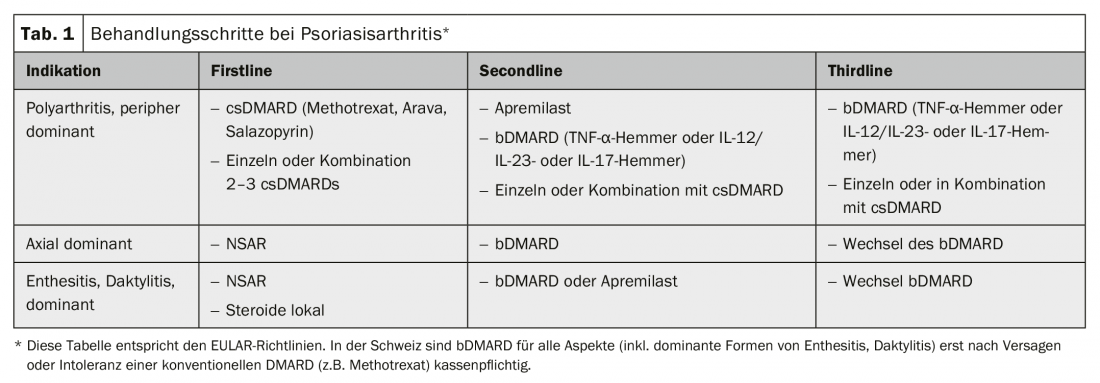
Eine möglichst frühe Diagnosestellung ist wichtig zur Gewährleistung einer zeitgerechten Therapie, um Folgeschäden und assoziierte sozioökonomische Konsequenzen zu verhindern. Einer der stärksten Biomarker für die Entwicklung einer PsA ist eine prävalente Psoriasis. Haut und Nägel sind deshalb genau zu untersuchen, nicht nur an den typischen Prädilektionsstellen wie Streckseiten von betroffenen Gelenken: Auch Haarkranz, Gehörgänge, Bauchnabel, Gesässspalte etc. sollen geprüft werden. Als Sonderform wird eine palmoplantare Pustolose inbesondere bei dem der Psoriasisarthritis verwandten SAPHO-Syndrom gesehen. Orientierung bei der Diagnosestellung bieten die CASPAR-Klassifikationskriterien (Tab. 1) [5].
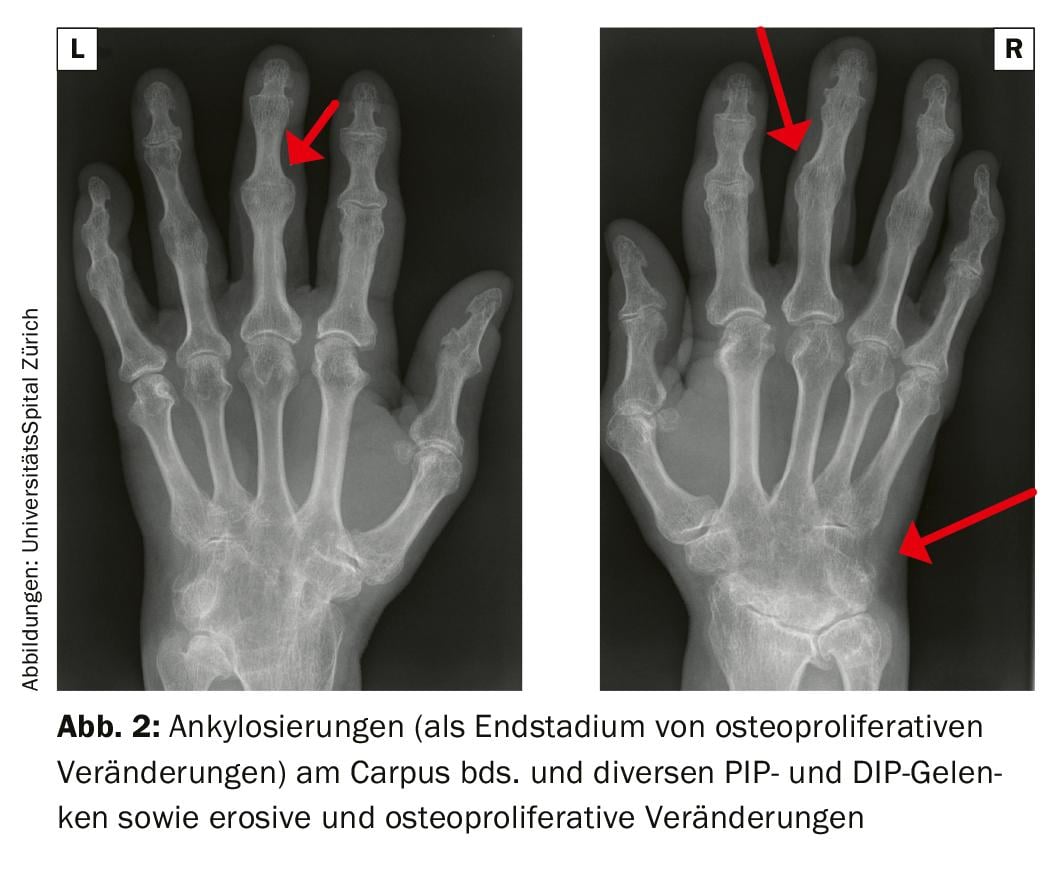
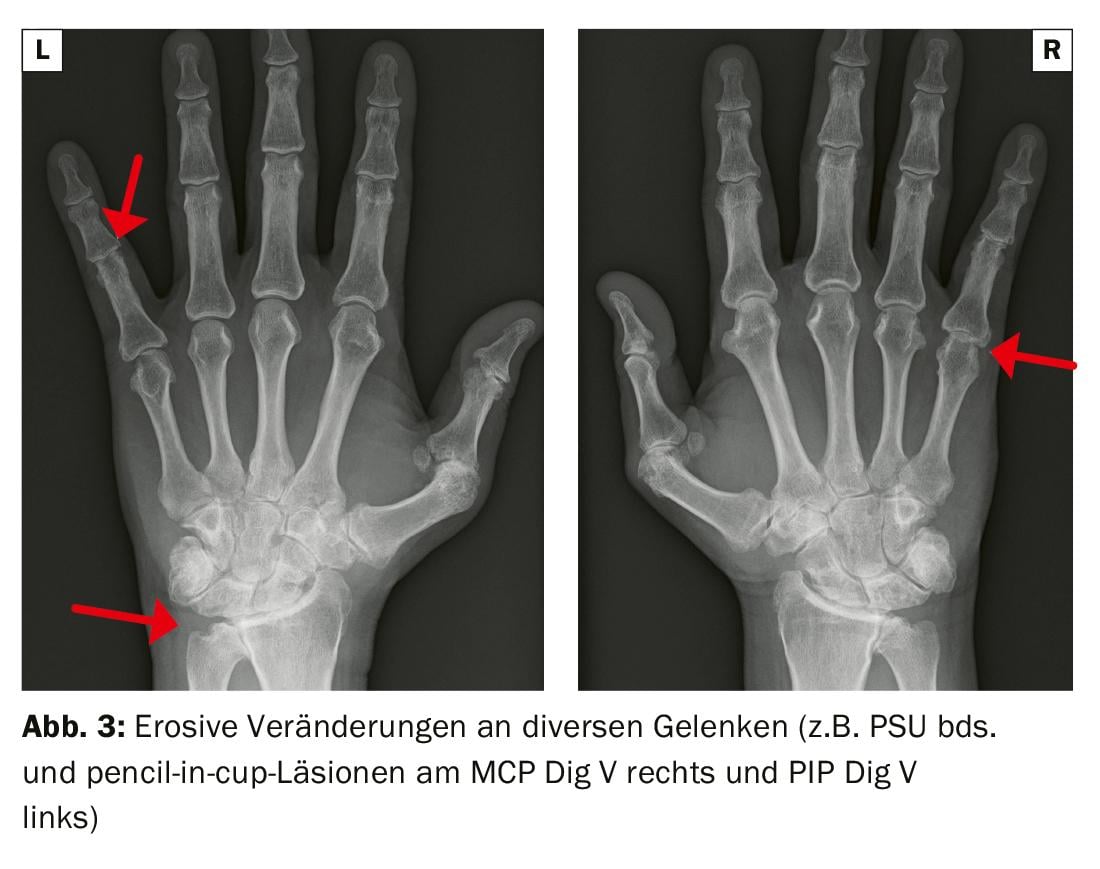
In der Bildgebung typisch ist das Mischbild aus Erosionen und periostalen Knochenneuformationen. Bei der mutilierenden Form können Veränderungen bis hin zu Akroosteolysen (Knochenauflösungen der Finger- oder Zehenendglieder) oder typischen pencil-in-cup-Formationen infolge Osteolysen, welche die mittlere Phalanx zuspitzen, auftreten (Abb. 2 und 3). Zur Standortbestimmung mit Frage nach Destruktionen/Osteoproliferationen werden konventionelle Röntgenaufnahmen von Händen und Füssen sowie der Wirbelsäule und des Beckens empfohlen. Die Sonografie und alternativ das MRI am Achsenskelett eignen sich zur erweiterten Diagnostik, beispielsweise zur Abgrenzung gegenüber einer rheumatoiden Arthritis, und zur Überprüfung der Krankheitsaktivität. Im Rheumalabor sind negative Rheumafaktoren zu erwarten, die CPP-Antikörper können niedrigtitrig positiv ausfallen. Ein positives HLA-B27-Genmerkmal ist mit axialem Befall und Uveitis assoziiert.
Jedoch können nicht alle muskuloskelettalen Beschwerden bei Psoriasis vulgaris per se auf eine Psoriasisarthritis zurückgeführt werden. Differenzialdiagnosen sind andere Erkrankungen aus dem Formenkreis der Spondylarthritiden, rheumatoide Arthritis, Kristallarthritis oder degenerative Erkrankungen [6].
Therapie
Die bei der rheumatoiden Arthritis erprobten Konzepte der zielgerichteten Therapie («treat to target») mit einer engmaschigen Kontrolle («tight control») haben sich auch bei der PsA als gültig und wirksam erwiesen, um eine Remission oder – falls nicht möglich – eine minimale Krankheitsaktivität (MDA) zu erreichen. Gemessen wird diese über den Aktivitätsscore, der aus verschiedenen Paramatern wie Krankheitsaktivität, Entzündungswerten und Status zusammengesetzt ist. Im klinischen Alltag sind insbesondere die Scores DAS 28 [7] und ASDAS [8] gebräuchlich. Je früher die Therapie begonnen werden kann, umso eher wird eine Remission erzielt («window of opportunity»).
Aktualisierte therapeutische Leitlinien liegen aus dem Jahr 2015 von der European League Against Rheumatism (EULAR) und der Group for Research and Assessment of Psoriasis and Psoriasisarthritis (GRAPPA) vor [9]. Die Leitlinien wurden in den Tabellen 2 und 3 vereinfachend zusammengefasst. Die Therapie richtet sich nach der Manifestationsart der PsA und wird je nach Befallsschwere und Ansprechen auf vorherige immunmodulatorische Therapeutika stufenweise ausgebaut. Die Empfehlungen der beiden Guidelines unterscheiden sich gering, wobei die EULAR primär die rheumatologischen Aspekte und die GRAPPA sowohl rheumatologische als auch dermatologische Aspekte berücksichtigt.
NSAR werden im Initialstadium bei Gelenksschmerzen ohne Schwellungen und bei axialem Befall sowie bei Bedarf als Begleittherapie verschrieben. Steroide werden in erster Linie als Zusatztherapie lokal gespritzt und per oral nur sehr zurückhaltend eingesetzt.
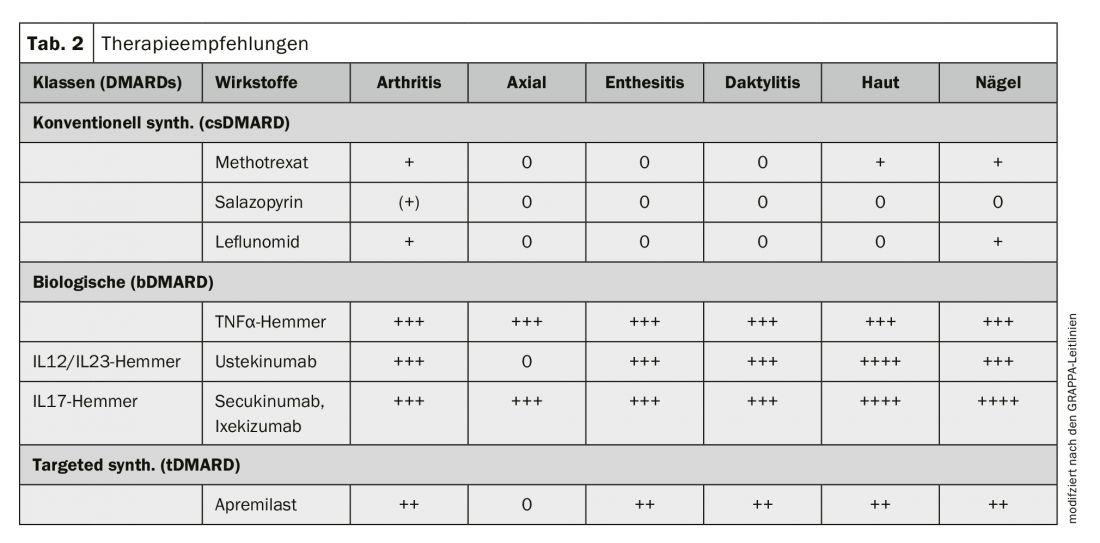
Die krankheitsmodifizierenden Substanzen («disease modifying antirheumatic drugs») werden in verschiedene Gruppen eingeteilt. Die ältesten und kostengünstigsten Präparate – sog. konventionell synthetische krankheitsmodifzierende Substanzen – wie Methotrexat (vorzugsweise subkutan), Leflunomid (oral) oder Sulfasalazin (oral) werden bei Synovitiden zuerst angewendet, sind aber bei axialem Befall, Enthesitiden und Daktylitiden nicht wirksam. Hier und bei Versagen der csDMARDs kommen primär biologische DMARDs, TNFα-Hemmer (Etanercept; Adalimumab; Golimumab; Certolizumab pegol, alle s.c.; Infliximab, per Infusion) oder die neuen IL17-Hemmer (Secukinumab; Ixekizumab, beide s.c.) und IL12/IL23-Hemmer (Ustekinumab, s.c. oder i.v.) zum Einsatz. Bei fehlender respektive ungenügender Wirkung oder Wirkungsverlust werden TNFα-Blocker oder Substanzklassen gewechselt. Das neuere, zielgerichtet synthetische DMARD Apremilast, eine Tablettentherapie, ist bei Arthritis, Enthesitiden und Daktylitiden effektiv, allerdings weniger wirksam als Biologika. Eine Wirkung auf den Befall des Achsenskeletts konnte zudem nicht gezeigt werden.
Mitberücksichtigt werden bei der Therapiewahl auch allfällige Komorbiditäten. TNFα-Hemmer beispielsweise sind bei der Multiplen Sklerose kontraindiziert, IL17A-Hemmer können Morbus Crohn-Schübe auslösen. Weitere Informationen zu den Therapien und den notwendigen Vorabklärungen und unter Immunsuppression empfohlenen Impfungen finden sich im Arzneimittelcompendium oder auf der Internetseite der Schweizerischen Gesellschaft für Rheumatologie (Stand 6.12.18). In Entwicklung zur Behandlung der Psoriasisarthritis stehen der IL23-Hemmer Guselkumab, der in der Schweiz bereits zur Therapie der Psoriasis vulgaris zugelassen ist, der IL17-Rezeptor A-Hemmer Brodalumab sowie verschiedene Januskinase-Hemmer. Unter anderem wird die Indikationserweiterung von Tofacitinib erwartet, das in der Rheumatologie bereits zur Behandlung der rheumatoiden Arthritis eingesetzt wird. Studien existieren zu Bimekizumab, einem dualen Hemmer von IL17A und IL17F (Bimekizumab), zu dualen Hemmern von TNF-α und IL17A als auch zu völlig neuartigen Substanzen [10].
Take-Home-Messages
- 20–30% der von einer Psoriasis vulgaris Betroffenen weisen zusätzlich eine Arthritis auf. Der Schweregrad des Hautbefalls korreliert nicht mit demjenigen des Gelenksbefalls.
- Es gibt unterschiedliche Manifestationsarten der Psoriasisarthritis sowohl am peripheren wie auch axialen Skelett. Auch extraartikuläre Befallsmuster kommen vor, z.B. Uveitiden.
- Die Therapie der Psoriasisarthritis richtet sich nach der Manifestationsart. Es stehen diverse immunmodulierende Substanzen zur Verfügung, welche stufenweise eingesetzt werden.
Literatur:
- Stolwijk C, et. al.: Epidemiology of spondyloarthritis. Rheum Dis Clin North Am 2012; 38(3): 441–476.
- Moll JM, Wright V: Psoriatic arthritis. Semin Arthritis Rheum 1973; 3(1): 55–78.
- Husni ME: Comorbidities in Psoriatic Arthritis. Rheum Dis Clin North Am 2015; 41(4): 677–698.
- Goupille P, Soutif D, Valat JP: Psoriatic arthritis precipitated by physical trauma. J Rheumatol 1991; 18(4): 633.
- Taylor W, et al.: Classification criteria for psoriatic arthritis: development of new criteria from a large international study. Arthritis Rheum 2006; 54(8): 2665–2673.
- Van den Bosch F, Coates L: Clinical management of psoriatic arthritis. Lancet 2018; 391(10136): 2285–2294.
- Prevoo ML, et al.: Modified disease activity scores that include twenty-eight-joint counts. Development and validation in a prospective longitudinal study of patients with rheumatoid arthritis. Arthritis Rheum 1995; 38(1): 44–48.
- van der Heijde D, et al.: ASDAS, a highly discriminatory ASAS-endorsed disease activity score in patients with ankylosing spondylitis. Ann Rheum Dis 2009; 68(12): 1811–1818.
- Gossec L, et al.: Management of psoriatic arthritis in 2016: a comparison of EULAR and GRAPPA recommendations. Nat Rev Rheumatol 2016; 12(12): 743–750.
- Elalouf O, Chandran V: Novel therapeutics in Psoriatic Arthritis. What is in the pipeline? Curr Rheumatol Rep 2018; 20(7): 36.
DERMATOLOGIE PRAXIS 2019; 29(5): 20–22
Autoren
- Dr. med. Christina Ryser
- Prof. Dr. med. Adrian Ciurea
Publikation
- DERMATOLOGIE PRAXIS




Comments are closed.