An der United European Gastroenterology Week (UEGW), welche vom 14. bis 17. Oktober 2023 stattfand, wurden Daten der aktuellen SEQUENCE-Studie vorgestellt und mittlerweile publiziert [1,2]. In der randomisierten Phase-III-Head-to-Head-Studie wurde Risankizumab (SKYRIZI®) mit Ustekinumab zur Behandlung erwachsener Patient:innen mit mittelschwerem bis schwerem aktivem Morbus Crohn (CD, Crohn’s Disease) verglichen, bei denen eine oder mehrere Anti-TNF-Therapien versagt hatten [1]. Risankizumab erreichte im Vergleich zu Ustekinumab alle primären und sekundären Endpunkte und demonstrierte Überlegenheit [1]. Bei SEQUENCE handelt es sich somit um die einzige Head-to-Head-Studie bei Morbus Crohn, welche eine Überlegenheit eines Biologikums gegenüber einem anderen Biologikum zeigt.
Morbus Crohn ist für die Betroffenen stark belastend: Die zugrunde liegende Entzündung kann dauerhafte Darmschäden verursachen und die Lebensqualität der Betroffenen massgeblich einschränken [3, 4]. Für die Behandlung des Morbus Crohn gibt es in der Schweiz unter anderem die zwei zugelassenen Interleukin (IL)-23- respektive IL-12/-23-Inhibitoren Risankizumab und Ustekinumab [5, 6]. Risankizumab ist seit dem 14.09.2023 in der Schweiz zugelassen zur Behandlung von erwachsenen Patient:innen mit mittelschwerem bis schwerem aktivem Morbus Crohn, die unzureichend auf eine konventionelle Therapie oder ein Biologikum angesprochen haben, nicht mehr ansprechen oder diese(s) nicht vertragen haben [5]. Da Risankizumab zu signifikanter klinischer und endoskopischer Remission führt und somit zur Mukosaheilung beitragen kann, handelt es sich um einen wichtigen Meilenstein in der Therapielandschaft von Morbus Crohn [7, 8].
Die SEQUENCE-Studie im Detail [1]
Über 500 Patient:innen mit Versagen auf einen oder mehrere TNF-Hemmer wurden randomisiert und während 48 Wochen entweder mit Risankizumab (N=255, 3x 600 mg i.v. in den Wochen 0, 4 und 8; 5x 360 mg s.c. in den Wochen 12, 20, 28, 36 und 44) oder Ustekinumab (N=265, 1x 260/390/520 mg i.v. in Woche 0; 5x 90 mg s.c. in den Wochen 8, 16, 24, 32 und 40) open-label behandelt [1]. Erster primärer Endpunkt war die klinische Remission gemäss Crohn’s Disease Activity Index (CDAI), definiert als CDAI < 150 nach 24 Wochen, getestet auf Nichtunterlegenheit. Beim zweiten primären Endpunkt handelte es sich um die endoskopische Remission gemäss Simple Endoscopic Score for Crohn’s Disease (SES-CD), definiert als SES-CD ≤ 4 und mindestens 2 Punkte niedriger als der Ausgangswert nach 48 Wochen, hier getestet auf Überlegenheit. Die endoskopischen Ergebnisse wurden im “central reading” verblindet ausgewertet. Die demografische Ausgangssituation war in beiden Behandlungsarmen ausgeglichen [1].
Risankizumab hat beide primären Endpunkte erreicht [1]
Bis zum Auslesepunkt nach 48 Wochen nahmen noch 90,2 % der Risankizumab-Patient:innen an der Studie teil im Vergleich zu 72,8 % der Ustekinumab-Patient:innen. Ein Hauptgrund für das vorzeitige Abbrechen im Ustekinumab-Arm war eine mangelnde Wirksamkeit bei 13,2 % der Patient:innen, während nur 2,0 % der Risankizumab-Patient:innen deshalb aus der Studie ausschieden [1]. Beide primären Endpunkte der Studie wurden erreicht (Abb. 1). Nach 24 Wochen erreichten 58,6 % der Patient:innen in der Risankizumab-Gruppe eine klinische Remission gegenüber 39,5 % der Ustekinumab-Patient:innen, womit Risankizumab Nichtunterlegenheit gegenüber Ustekinumab bei einer Nichtunterlegenheitsspanne von 10 % demonstrierte [1]. Darüber hinaus zeigte Risankizumab bereits nach 24 Wochen einen Hinweis auf eine Überlegenheit gegenüber Ustekinumab (p < 0,01, Post-hoc-Analyse für Überlegenheit) [2]. Beim zweiten koprimären Endpunkt, der endoskopischen Remission, wurde nach 48 Wochen eine Überlegenheit von Risankizumab gegenüber Ustekinumab festgestellt. Beinahe doppelt so viele Patient:innen unter Risankizumab erreichten eine endoskopische Remission im Vergleich zu Ustekinumab (31,8 % vs. 16,2 %, p < 0,0001) [1].
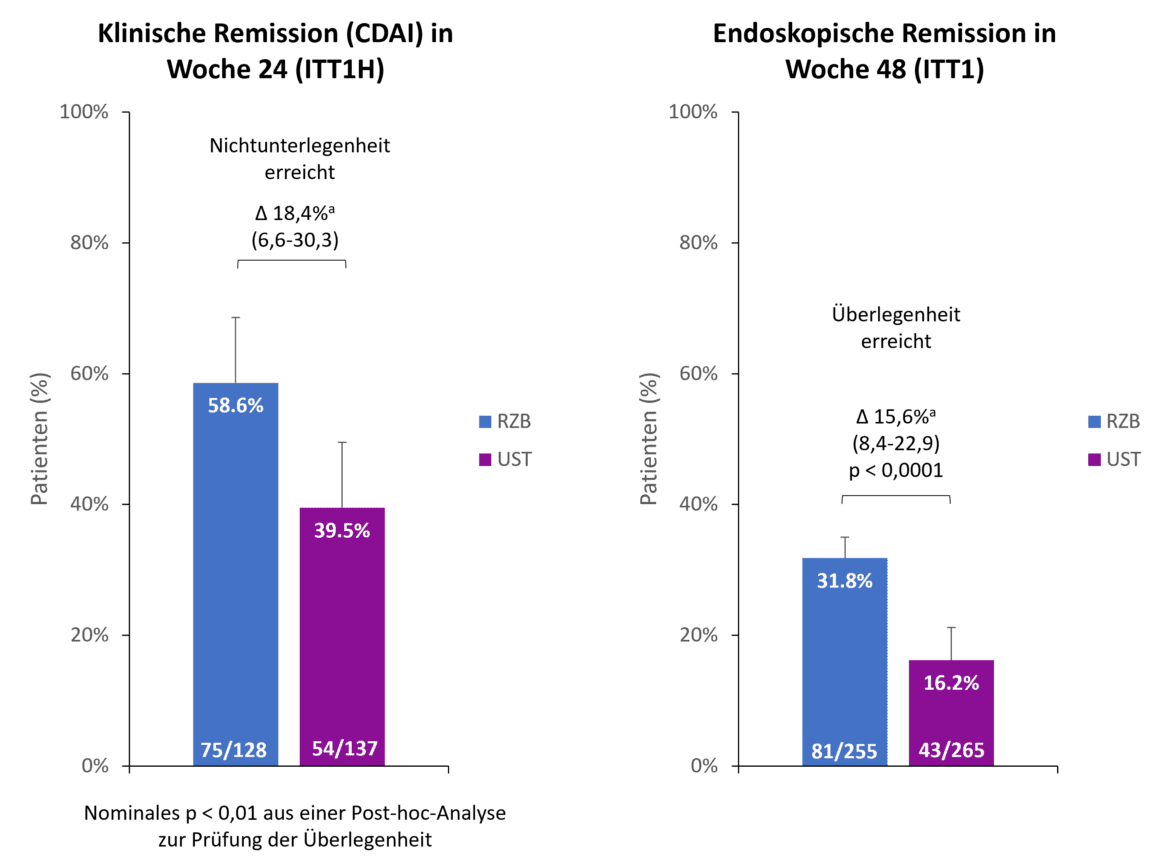
Abb. 1. Primäre Endpunkte: Risankizumab (RZB) demonstrierte Nichtunterlegenheit gegenüber Ustekinumab (UST) beim Erreichen einer klinischen Remission in Woche 24 und Überlegenheit gegenüber UST beim Erreichen einer endoskopischen Remission in Woche 48. a Die Unterschiede sind anhand der Stratifizierungsfaktoren bereinigt (Anzahl der erfolglosen vorherigen Anti-TNF-Therapien [≤ 1, > 1] und Steroidgebrauch bei Studienbeginn [ja, nein]). ITT1H: randomisierte, behandelte Patienten, die zum Analysezeitpunkt (Interimsanalyse zu Woche 24) mindestens 24 Wochen behandelt wurden; ITT1: randomisierte Patienten, die mindestens 1 Dosis von RZB resp. UST erhalten haben; CDAI: Crohn’s Disease Activity Index; RZB: Risankizumab; UST: Ustekinumab. Adaptiert nach [1, 2].
Risankizumab zeigte Überlegenheit gegenüber Ustekinumab in allen sekundären Endpunkten [1]
Auch bei den sekundären Endpunkten der SEQUENCE-Studie, klinische Remission nach 48 Wochen, endoskopisches Ansprechen nach 24 und 48 Wochen sowie steroidfreie endoskopische und klinische Remission nach 48 Wochen, zeigte Risankizumab im Vergleich zu Ustekinumab Überlegenheit (Abb. 2). So befanden sich zum Beispiel 60,8 % der Risankizumab-Patient:innen nach 48 Wochen in klinischer Remission gegenüber 40,8 % der Ustekinumab-Patient:innen (p<0,0001). Der Unterschied im endoskopischen Ansprechen zwischen Risankizumab und Ustekinumab war nach 48 Wochen noch ausgeprägter als nach 24 Wochen (45,1 % vs. 21,9 %, p<0,0001) [1].
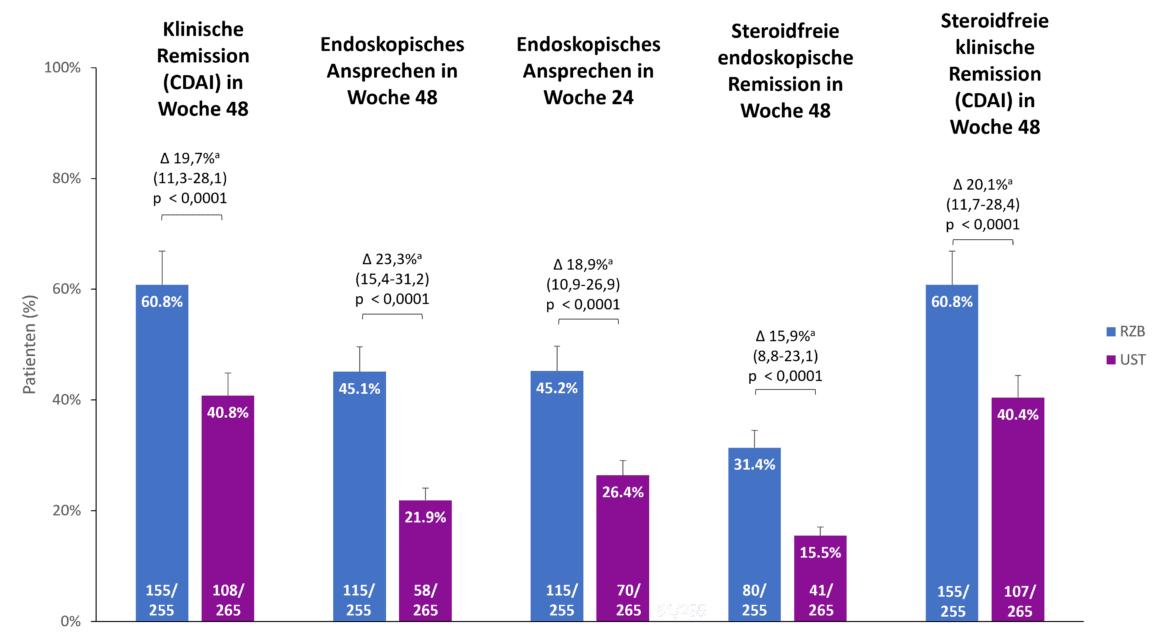
Abb. 2. Risankizumab (RZB) zeigte Überlegenheit gegenüber Ustekinumab (UST) bei allen sekundären Endpunkten. a Die Unterschiede sind anhand der Stratifizierungsfaktoren bereinigt (Anzahl der erfolglosen vorherigen Anti-TNF-Therapien [≤ 1, > 1] und Steroidgebrauch bei Studienbeginn [ja, nein]). CDAI: Crohn’s Disease Activity Index; RZB: Risankizumab; UST: Ustekinumab. Adaptiert nach [1, 2].
Sicherheitsprofil von Risankizumab
Die Gesamthäufigkeit von therapiebedingten Nebenwirkungen (TEAE, “treatment-emergent adverse events”) war bei Risankizumab und Ustekinumab niedrig (27,9% vs. 21,9%). 16,0% der Patient:innen im Risankizumab-Arm hatten schwerwiegende Nebenwirkungen im Vergleich zu 19,2% im Ustekinumab-Arm. In beiden Behandlungsarmen gab es wenige TEAE, die zum Absetzen des Studienmedikamentes führten (Risankizumab 3,8% vs. Ustekinumab 4,9%) [1]. Im Vergleich zu den Zulassungsstudien wurden keine neuen Sicherheitssignale unter Risankizumab identifiziert [1, 7, 8].
Fazit
Die aktuellen Daten der SEQUENCE-Studie bestätigen das kürzlich zugelassene Biologikum Risankizumab als wirksame Behandlungsoption für Patient:innen mit Morbus Crohn. Im Direktvergleich mit Ustekinumab bei anti-TNF-refraktären Patient:innen zeigte sich Risankizumab überlegen und alle primären und sekundären Endpunkte wurden erreicht [1]. Die klinische wie auch die endoskopische Remission und Mukosaheilung als Therapieziele rücken somit näher und Patient:innen mit Morbus Crohn dürfen auf eine niedrigere Krankheitsaktivität hoffen und sich auf eine vielversprechende neue Therapie freuen.
Literatur
- Peyrin-Biroulet, L., et al. Risankizumab versus Ustekinumab for Moderate-to-Severe Crohn’s Disease. N Engl J Med, 2024. 391(3): p. 213-223.
- Peyrin-Biroulet, L., et al. Risankizumab Versus Ustekinumab for Patients With Moderate to Severe Crohn’s Disease: Results From the Phase 3b SEQUENCE Study. UEGW; Copenhagen, Oct 14-16, 2023.
- Jairath, V. and B.G. Feagan, Global burden of inflammatory bowel disease. Lancet Gastroenterol Hepatol, 2020. 5(1): p. 2-3.
- The global, regional, and national burden of inflammatory bowel disease in 195 countries and territories, 1990-2017: a systematic analysis for the Global Burden of Disease Study 2017. Lancet Gastroenterol Hepatol, 2020. 5(1): p. 17-30.
- Aktuelle Fachinformation von SKYRIZI® (Risankizumab) Morbus Crohn auf www.swissmedicinfo.ch.
- Aktuelle Fachinformation von Ustekinumab auf www.swissmedicinfo.ch.
- D’Haens, G., et al., Risankizumab as induction therapy for Crohn’s disease: results from the phase 3 ADVANCE and MOTIVATE induction trials. Lancet, 2022. 399(10340): p. 2015-2030.
- Ferrante, M., et al., Risankizumab as maintenance therapy for moderately to severely active Crohn’s disease: results from the multicentre, randomised, double-blind, placebo-controlled, withdrawal phase 3 FORTIFY maintenance trial.Lancet, 2022. 399(10340): p. 2031-2046.
Die Referenzen können durch Fachpersonen bei medinfo.ch@abbvie.com angefordert werden.
Bericht: Dr. sc. nat. Stefanie Jovanovic
Dieser Beitrag entstand mit finanzieller Unterstützung der AbbVie AG, Alte Steinhauserstrasse 14, Cham.
CH-SKZG-240059 09/2024




Comments are closed.