Ein ischämischer Schlaganfall ist ein medizinischer Notfall, bei dem jede Minute zählt. Die Behandlung erfolgt heute in spezialisierten Zentren durch erfahrene Teams und umfasst moderne Verfahren wie die systemische Thrombolyse und die endovaskuläre Thrombektomie. In diesem Artikel, der auf INFO NEUROLOGIE & PSYCHIATRIE basiert, erfahren Sie, wie eine schnelle Diagnose und gezielte Therapie die Überlebenschancen und die Lebensqualität nach einem Schlaganfall entscheidend verbessern können.
Was ist ein ischämischer Schlaganfall und warum ist die schnelle Behandlung so wichtig?
Ein ischämischer Schlaganfall entsteht, wenn ein Blutgefäß im Gehirn plötzlich verstopft und dadurch ein Teil des Gehirns nicht mehr ausreichend mit Sauerstoff und Nährstoffen versorgt wird. Dies führt zu einem sogenannten fokal neurologischen Defizit (also einer plötzlich auftretenden Funktionsstörung in einem bestimmten Bereich des Nervensystems). In den industrialisierten Ländern ist der ischämische Schlaganfall mit etwa 150 Fällen pro 100.000 Einwohner pro Jahr die dritthäufigste Todesursache und die häufigste Ursache für bleibende Behinderungen im Erwachsenenalter. Fast die Hälfte der Überlebenden bleibt dauerhaft eingeschränkt oder pflegebedürftig. Eine schnelle und gezielte Behandlung im Krankenhaus kann die Überlebenschancen deutlich erhöhen und das Risiko für bleibende Schäden verringern.
Die Behandlung sollte möglichst in einer sogenannten Stroke Unit oder einem Stroke Center erfolgen. Dort arbeitet ein spezialisiertes Team aus verschiedenen Fachrichtungen zusammen, um die bestmögliche Versorgung sicherzustellen. Die wichtigsten Therapien in der Akutphase sind die systemische Thrombolyse (Auflösung des Blutgerinnsels durch Medikamente) und, bei Verschluss eines größeren Gefäßes, die endovaskuläre Thrombektomie (mechanische Entfernung des Gerinnsels). Der Erfolg dieser Behandlungen hängt entscheidend davon ab, wie schnell sie nach Auftreten der Symptome eingeleitet werden. Daher ist es besonders wichtig, die Anzeichen eines Schlaganfalls frühzeitig zu erkennen und sofort den Rettungsdienst zu rufen.
Zu den häufigsten Symptomen eines akuten Schlaganfalls gehören plötzlich auftretende Lähmungen oder Gefühlsstörungen auf einer Körperseite, Sprachstörungen, Sehstörungen wie Gesichtsfeldausfälle oder Doppelbilder, Koordinationsprobleme und Schwindel. Wenn Sie oder eine andere Person solche Symptome bemerken, zögern Sie nicht, sofort die Notrufnummer 144 zu wählen und den Transport in ein spezialisiertes Krankenhaus zu veranlassen.
Wie entstehen die Schäden im Gehirn? – Penumbra und Infarktkern
Um zu verstehen, warum die Zeit bei einem Schlaganfall so eine große Rolle spielt, ist es hilfreich, die Vorgänge im Gehirn genauer zu betrachten. Das Gehirn benötigt ständig Sauerstoff und Energie, um seine Zellen am Leben zu erhalten. Der sogenannte Strukturstoffwechsel (Erhalt der Zellstruktur) ist dafür verantwortlich, dass die Zellen nicht zugrunde gehen. Zusätzlich sorgt der Funktionsstoffwechsel (Bereitstellung von Energie für die Funktion der Nervenzellen) dafür, dass die Nervenzellen ihre Aufgaben erfüllen können.
Wenn die Durchblutung unter eine kritische Grenze – die sogenannte Ischämieschwelle – fällt, versagt zunächst der Funktionsstoffwechsel. Das führt zu Störungen der elektrischen Aktivität der Nervenzellen und damit zu den typischen Symptomen eines Schlaganfalls. Diese Funktionsstörung ist in der Regel noch umkehrbar, wenn die Durchblutung rasch wiederhergestellt wird. Im Zentrum des betroffenen Bereichs, dem sogenannten Infarktkern, ist die Durchblutungsstörung jedoch so stark, dass die Zellen schnell unwiderruflich geschädigt werden. Um diesen Kern herum liegt die Penumbra, eine Randzone, in der noch etwas Blut über Umwege (Kollateralen) ankommt. In der Penumbra sind die Zellen zwar gestört, aber noch nicht abgestorben – sie können durch eine schnelle Behandlung gerettet werden.
Im Verlauf der Zeit breitet sich der Infarktkern immer weiter aus und nimmt dabei Teile der Penumbra ein. Wie schnell dieser Prozess abläuft, ist von Mensch zu Mensch unterschiedlich und hängt vor allem davon ab, wie gut die Kollateralgefäße ausgebildet sind. Deshalb ist es so wichtig, keine Zeit zu verlieren und die Behandlung so früh wie möglich zu beginnen.
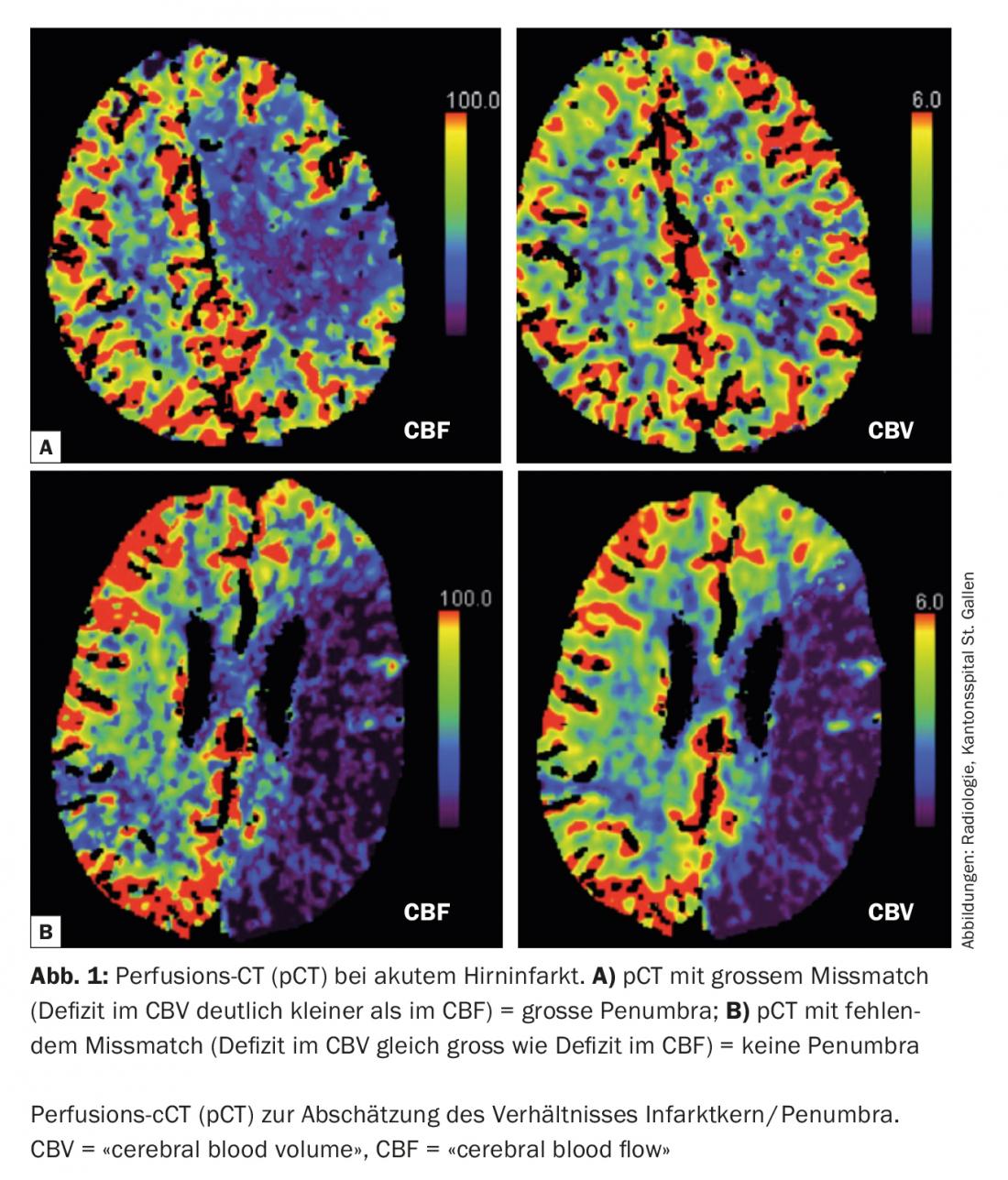
Mit modernen bildgebenden Verfahren wie der Computertomografie (CT) oder Magnetresonanztomografie (MRI) kann heute in der Akutsituation die Größe von Infarktkern und Penumbra abgeschätzt werden. Diese Information hilft den Ärzten, die beste Therapie für den einzelnen Patienten auszuwählen – vor allem in schwierigen Entscheidungssituationen, wenn nicht klar ist, ob eine Behandlung noch sinnvoll ist. Außerdem kann die Bildgebung helfen, sogenannte Stroke mimics (Erkrankungen, die einen Schlaganfall vortäuschen, aber eine andere Ursache haben) zu erkennen und unnötige oder sogar schädliche Therapien zu vermeiden.
Verschiedene Formen und Ursachen des ischämischen Schlaganfalls
Ischämischer Schlaganfall ist nicht gleich ischämischer Schlaganfall – es gibt verschiedene Formen und Ursachen, die für die Behandlung und Vorbeugung eine wichtige Rolle spielen. Die Symptome werden nach der sogenannten Oxford Community Stroke Project Classification eingeteilt. Dabei unterscheidet man zwischen Schlaganfällen im vorderen Kreislauf (Versorgung durch die großen Hirnarterien), im hinteren Kreislauf (Versorgung durch die Arterien des Hirnstamms und Kleinhirns) und lakunären Syndromen (kleine Infarkte in tieferen Hirnregionen). Im vorderen Kreislauf spricht man je nach Ausdehnung des Infarkts von einem Total Anterior Circulation Syndrome (TACS) oder einem Partial Anterior Circulation Syndrome (PACS). Das Posterior Circulation Syndrome (POCS) betrifft den hinteren Kreislauf. Liegt ein rein motorisches (Bewegung betreffendes), sensibles (Gefühl betreffendes), sensomotorisches oder ataktisches (Koordination betreffendes) Hemisyndrom ohne sogenannte kortikale Zeichen (wie Sprachstörung oder Vernachlässigung einer Körperseite) vor, spricht man von einem lakunären Syndrom (LACS).
Auch die Ursachen (Ätiologie) des ischämischen Schlaganfalls sind vielfältig. Die bekannteste Einteilung ist die TOAST-Klassifikation. Sie unterscheidet folgende Hauptgruppen:
- Makroangiopathie: Schlaganfall durch eine atherosklerotische (durch Ablagerungen verengte) große Hirnarterie, meist mit einer Verengung (Stenose) von mehr als 50 %.
- Kardial embolisch: Schlaganfall durch ein Blutgerinnsel, das im Herzen entsteht und ins Gehirn verschleppt wird (zum Beispiel bei Vorhofflimmern).
- Mikroangiopathie: Kleine Infarkte (Durchmesser unter 15 mm) in tieferen Hirnregionen, meist durch Veränderungen der kleinen Blutgefäße.
- Andere Ätiologie: Zum Beispiel Gefäßdissektion (Einriss der Gefäßwand) oder Gerinnungsstörungen.
- Unklare Ätiologie: Wenn keine eindeutige Ursache gefunden werden kann oder mehrere mögliche Ursachen vorliegen.
Eine neuere und differenziertere Einteilung ist die ASCOD-Klassifikation. Sie wurde 2009 eingeführt und 2013 überarbeitet. Hier werden fünf Phänotypen unterschieden: A (Makroangiopathie), S (Mikroangiopathie), C (Kardiopathie), O (andere Ursache) und D (Dissektion). Jeder Phänotyp wird in drei Stufen der Kausalität eingeteilt: 1 = Erkrankung vorhanden und potenzielle Ursache, 2 = Erkrankung vorhanden, aber Kausalität ungewiss, 3 = Erkrankung vorhanden, Kausalität unwahrscheinlich, 0 = Erkrankung nicht vorhanden, 9 = ungenügende Abklärung. Vorteil dieser Einteilung ist, dass sie flexibler ist als die TOAST-Klassifikation und keine starre Gruppierung oder kryptogene (unbekannte Ursache) Gruppe benötigt.
Ein weiteres Konzept ist der sogenannte Embolic Stroke of Undetermined Source (ESUS), also ein embolischer ischämischer Schlaganfall unbekannter Ursache. Hier werden durch Bildgebung lakunäre Infarkte ausgeschlossen und relevante Gefäßverengungen im betroffenen Gebiet durch Ultraschall, CT-Angiografie (CTA) oder MR-Angiografie (MRA) ausgeschlossen. Zur Abklärung von Vorhofflimmern wird mindestens ein 24-Stunden-Holter-Monitoring (Langzeit-EKG) durchgeführt. Da für diese Patientengruppe bislang keine spezifischen Studien zur Sekundärprävention (Vorbeugung eines weiteren Schlaganfalls) vorliegen, laufen aktuell große Studien mit direkten oralen Antikoagulanzien wie Dabigatran oder Rivaroxaban im Vergleich zu Acetylsalicylsäure.
Von den ersten Symptomen bis zur Akuttherapie: Was passiert vor und im Krankenhaus?
Die Zeit zwischen dem Auftreten der ersten Symptome und dem Beginn der Behandlung ist entscheidend für das Behandlungsergebnis. Daher spricht man auch von „time is brain“ – jede Minute zählt, denn mit jeder Minute sterben mehr Nervenzellen ab. Das rasche Erkennen der Symptome und das richtige Handeln sind sowohl für Laien als auch für medizinisches Personal von großer Bedeutung.
Die häufigsten Symptome eines akuten Schlaganfalls sind plötzlich auftretende Lähmungen oder Gefühlsstörungen auf einer Körperseite, Sprachstörungen, Sehstörungen (Gesichtsfeldausfälle, Doppelbilder), Koordinationsstörungen und Schwindel. Wenn solche Symptome auftreten, sollte sofort der Rettungsdienst (Telefon 144) alarmiert werden. Der Patient sollte in ein spezialisiertes Zentrum mit Akutbehandlungsauftrag gebracht werden, möglichst im Rahmen eines Schlaganfallnetzwerks.
In der Schweiz gibt es mittlerweile ein gut ausgebautes Netz von zertifizierten Schlaganfallzentren (derzeit 9) und Stroke Units (14), die eine flächendeckende und qualitativ hochwertige Versorgung ermöglichen. Dennoch dauert es oft länger als eine Stunde, bis ein Patient nach Symptombeginn tatsächlich eine Akuttherapie erhält. Die wichtigsten Gründe für Verzögerungen sind mangelndes Wissen in der Bevölkerung, das Nicht-Erkennen der Symptome und eine nicht optimale Organisation des Transports ins richtige Krankenhaus.
Zu den Sofortmaßnahmen vor Ort gehören: eine 30°-Oberkörperhochlagerung (um das Risiko einer Lungenentzündung zu verringern) oder eine stabile Seitenlage bei Aspirationsgefahr (Gefahr, dass Speichel oder Erbrochenes in die Lunge gelangt). Puls- und Blutdruck sollten überwacht werden, wobei ein zu hoher Blutdruck erst behandelt wird, wenn er einen kritischen Wert (systolisch über 220 mmHg) überschreitet. Wichtig ist auch die Kontrolle des Blutzuckers, das Freihalten der Atemwege und eine zusätzliche Sauerstoffgabe (2–4 Liter pro Minute über die Nasenbrille). Eine periphere intravenöse Leitung sollte gelegt werden, um im Notfall Medikamente geben zu können. Die Gabe von Aspirin wird in dieser Phase nicht empfohlen, da noch nicht klar ist, ob es sich um einen ischämischen oder hämorrhagischen (durch Blutung verursachten) Schlaganfall handelt.

Im Krankenhaus steht die schnelle Wiedereröffnung des verschlossenen Gefäßes (Revaskularisation) im Mittelpunkt der Behandlung. Dafür stehen heute verschiedene, wissenschaftlich gut untersuchte Therapien zur Verfügung. Die Auswahl der Therapie richtet sich nach dem Zeitpunkt des Symptombeginns, dem Zustand des Patienten und den Ergebnissen der Bildgebung.
Moderne Akuttherapie: Thrombolyse, Thrombektomie und Stroke Unit
Nach der Aufnahme im Krankenhaus erfolgt zunächst eine neurologische Untersuchung und eine bildgebende Diagnostik (CT oder MRI), um die Art des Schlaganfalls festzustellen und andere Ursachen auszuschließen. Wenn keine Kontraindikationen vorliegen, wird in den ersten 4,5 Stunden nach Symptombeginn eine systemische Thrombolyse durchgeführt. Dabei wird ein rekombinanter Plasminogenaktivator (rt-PA) intravenös verabreicht, der das Blutgerinnsel auflöst. Der Nutzen dieser Therapie ist in vielen Studien und Metaanalysen belegt. Je früher die Thrombolyse erfolgt, desto besser ist die Prognose. Die sogenannte „number needed to treat“ (NNT, also die Anzahl der Patienten, die behandelt werden müssen, um bei einem Patienten ein gutes Ergebnis zu erzielen) steigt mit zunehmender Zeit: In den ersten 90 Minuten liegt sie bei 3, zwischen 0 und 3 Stunden bei 7 und zwischen 3 und 4,5 Stunden bei 14. Ein gutes funktionelles Ergebnis bedeutet, dass der Patient nach dem Schlaganfall wieder selbstständig leben kann. Der positive Effekt der Thrombolyse gilt für alle Altersgruppen und Schweregrade.
Bei Verschluss eines größeren Hirngefäßes hat sich in den letzten Jahren die endovaskuläre Thrombektomie als ergänzende Therapie etabliert. Bis 2015 fehlte der eindeutige Wirksamkeitsnachweis, doch mit der Veröffentlichung mehrerer großer Studien (MR CLEAN, ESCAPE, REVASCAT, SWIFT PRIME und EXTEND IA) wurde die Überlegenheit dieser Methode belegt. In diesen Studien erhielten Patienten mit einem proximalen Gefäßverschluss im vorderen Hirnkreislauf entweder eine Thrombektomie (mechanische Entfernung des Gerinnsels mittels Katheter) oder eine systemische Thrombolyse. Patienten mit bereits großem Infarkt, Infarkt im hinteren Kreislauf oder relevanter Vorerkrankung waren ausgeschlossen. Der Behandlungserfolg wurde anhand der „modified Rankin Scale“ (mRS, misst die Behinderung nach Schlaganfall) nach 90 Tagen bewertet. Die Metaanalysen zeigen eine odds ratio (OR) von 2,42 für ein gutes funktionelles Ergebnis (mRS 0–2) und eine NNT von 5. Für eine Verbesserung um mindestens einen Punkt auf der mRS liegt die NNT sogar nur bei 2,6. Alle Patientengruppen profitieren von der Thrombektomie, sofern sie richtig ausgewählt werden. Die Auswahl erfolgt mithilfe moderner Bildgebung inklusive Angiografie, um einen proximalen Gefäßverschluss nachzuweisen und das Ausmaß des Infarkts zu bestimmen. Als technischer Standard gelten sogenannte Stentretriever. Das Zeitfenster für die Thrombektomie liegt meist bei bis zu sechs Stunden nach Symptombeginn, in Einzelfällen auch länger. Noch offen ist die Frage, ob die Behandlung unter Sedierung oder in Vollnarkose erfolgen sollte.
Ein weiterer wichtiger Baustein der Akutbehandlung ist die Versorgung auf einer Stroke Unit. Zahlreiche Studien zeigen, dass Patienten auf einer Stroke Unit besser versorgt werden als auf einer normalen Station. Die Sterblichkeit im ersten Jahr nach dem Schlaganfall ist um 18–46 % (absolut 3 %) niedriger, und auch die Pflegebedürftigkeit sinkt um 25 %. Dieser Vorteil gilt für alle Patientengruppen. Eine Studie aus der Schweiz zeigte, dass die Behandlung auf einer Intensivstation mit anschließender Betreuung durch ein Schlaganfallteam ohne feste Station der Versorgung auf einer klar definierten Stroke Unit unterlegen ist. Das unterstreicht die Bedeutung einer flächendeckenden Versorgung in spezialisierten Einheiten.
Die Stroke Unit ist eine speziell ausgestattete Station, auf der Patienten mit Schlaganfall rund um die Uhr von einem interdisziplinären Team betreut werden. Hier werden nicht nur die Akuttherapien durchgeführt, sondern auch Komplikationen früh erkannt und behandelt, die Mobilisation und Rehabilitation eingeleitet und die weitere Diagnostik zur Ursachenklärung begonnen. Ziel ist es, die bestmögliche Genesung zu ermöglichen und das Risiko für erneute Schlaganfälle zu senken.
Nach der Akutphase: Rehabilitation und Prävention weiterer Schlaganfälle
Nach der Akutbehandlung beginnt die Phase der Rehabilitation und der Sekundärprävention (Vorbeugung weiterer Schlaganfälle). Die Rehabilitation startet meist schon auf der Stroke Unit und wird in spezialisierten Rehabilitationskliniken fortgesetzt. Ziel ist es, die verlorenen Fähigkeiten – zum Beispiel Beweglichkeit, Sprache oder Alltagskompetenzen – so weit wie möglich wiederherzustellen. Ein individuell angepasstes Rehabilitationsprogramm umfasst Physiotherapie, Ergotherapie, Logopädie und gegebenenfalls neuropsychologische Betreuung.
Die Sekundärprävention richtet sich nach der Ursache des Schlaganfalls. Bei Vorhofflimmern oder anderen kardialen Emboliequellen werden meist orale Antikoagulanzien wie Dabigatran, Rivaroxaban oder Apixaban eingesetzt, um das Risiko für weitere Gerinnsel zu senken. Bei atherosklerotischen Veränderungen der Gefäße stehen Plättchenhemmer wie Acetylsalicylsäure oder Clopidogrel im Vordergrund. Zusätzlich ist es wichtig, Risikofaktoren wie Bluthochdruck, Diabetes mellitus, erhöhte Blutfette und Rauchen konsequent zu behandeln. Auch regelmäßige Bewegung, gesunde Ernährung und der Verzicht auf Alkohol und Nikotin tragen dazu bei, das Risiko für einen erneuten Schlaganfall zu senken.
Für Patienten und Angehörige ist es hilfreich, sich über die Erkrankung und die Möglichkeiten der Nachsorge zu informieren. Viele Kliniken bieten spezielle Schulungen und Beratungen an. Auch Selbsthilfegruppen können eine wertvolle Unterstützung sein, um mit den Folgen des Schlaganfalls besser umzugehen und den Alltag zu meistern.
Die Forschung auf dem Gebiet des ischämischen Schlaganfalls entwickelt sich stetig weiter. Neue bildgebende Verfahren, innovative Therapien und individualisierte Präventionsstrategien werden in klinischen Studien untersucht, um die Behandlung und die Prognose für Betroffene weiter zu verbessern.
Dr. med. Jochen Vehoff
Quellen
- Poeck und Hacke 2001, 11. Auflage, Springer-Verlag Berlin, Heidelberg, New York.
- Bamford J, et al.: Classification and natural history of clinically identifiable subtypes of cerebral infarction. Lancet 1991; 337: 1521–1526.
- Adams HP, et al.: Classification of subtype of acute ischemic stroke. Definitions for use in a multicenter clinical trial. TOAST. Trial of Org 10172 in Acute Stroke Treatment. Stroke 1993; 24; 35–41.
- Amarenco P, et al.: A new approach to stroke subtyping: the A-S-C-O (phenotypic) classification of stroke. Cerebrovasc Dis 2009; 27: 502–508.
- Amarenco P, et al.: The ASCOD Phenotyping of Ischemic Stroke (Updated ASCO Phenotyping). Cerebrovasc Dis 2013; 36: 1–5.
- Diener HC, et al.: Kryptogener ischämischer Schlaganfall: Zeit für einen Paradigmenwechsel in Diagnose und Therapie? Akt Neurol 2014; 41(01): 35–39.
- Hacke W, et al.: Thrombolysis with alteplase 3 to 4.5 hours after acute ischemic stroke. N Engl J Med. 2008; 359(13): 1317–29.
- Emberson J, et al.: Effect of treatment delay, age, and stroke severity on the effects of intravenous thrombolysis with alteplase for acute ischaemic stroke: a meta-analysis of individual patient data from randomised trials. Lancet 2014; 384(9958): 1929–35.
- Sardar P, et al.: Endovascular therapy for acute ischaemic stroke: a systematic review and meta-analysis of randomized trials. Eur Heart J. 2015; 36(35): 2373–80.
- Goyal M, et al.: Endovascular thrombectomy after large-vessel ischaemic stroke: a meta-analysis of individual patient data from five randomised trials. Lancet. 2016; 387(10029): 1723–31.
- Stroke Unit Trialists’ Collaboration. Organised inpatient (stroke unit) care for stroke. Cochrane Database Syst Rev. 2007.
- Cereda C, et al.: Beneficial Effects of a Semi-Intensive Stroke Unit are Beyond the Monitor. Cerebrovasc Dis 2015; 39: 102–109.