Die Osteoporose und ihre Folgen müssen glücklicherweise nicht mehr als nichtbehandelbares Schicksal hingenommen werden. Dank intensiver Forschung auf diesem Gebiet stehen heute viele Möglichkeiten zur Prävention, zum frühzeitigen Erkennen und zur Therapie zur Verfügung. Verschiedene, im zweiten Halbjahr 2012 veröffentlichte Studien haben sich speziellen Gesichtspunkten der Osteoporosebehandlung gewidmet.
Das Lebenszeitrisiko, eine osteoporotische Fraktur zu erleiden, beträgt für die Schweizer Frau im Alter von 50 Jahren 51,3%, für den Mann 20,2% [1, 2]. Osteoporotische Frakturen bringen neben Einschränkungen der Lebensqualität und der Funktionsfähigkeit im Alltag auch eine erhöhte Mortalität mit sich. Ausserdem erhöht jede Fraktur das Risiko für weitere Frakturen.
Bisphosphonate immer zusammen mit Vitamin D?
Praktisch alle Leitlinien empfehlen bei einer Bisphosphonattherapie eine gleichzeitige Kalzium- und Vitamin-D-Supplementation. Zusätzlich wurde in den meisten Bisphosphonatstudien zusätzlich Vitamin D verabreicht. Dies, obwohl man kaum etwas über die Rolle von Vitamin D in der Bisphosphonatbehandlung der Osteoporose weiss. Wird die Wirkung dieser Medikamente durch Vitamin D unterstützt, oder braucht es Vitamin D gar, damit sie ihre Wirkung entfalten können?
Um diese Fragen zu klären, untersuchte eine spanische Gruppe bei 140 konsekutiven postmenopausalen Patientinnen ihrer Osteoporose-Sprechstunde, inwiefern der Abfall der Knochenabbau-Marker unter Bisphosphonaten vom Vi-tamin-D-Blutspiegel abhängt [3]. Über drei Monate erhielten die Frauen entweder Aldendronat plus 25OHD3 (ALN+VitD) oder Alendronat (ALN) allein. Der Vitamin-D3-Spiegel stieg in der ALN+VitD-Gruppe erwartungsgemäss signifikant an und blieb in der ALN-Gruppe unverändert, während die Spiegel der Knochenabbau-Marker in der ALN+VitD-Gruppe signifikant stärker abfielen als in der ALN-Gruppe. Betrachtete man die Frauen mit einem Ausgangs-Vitamin-D-Spiegel >20 ng/ml und diejenigen mit einem Spiegel <20 ng/ml jedoch getrennt, fiel auf, dass bei letzteren die Knochenabbau-Marker in der ALN+VitD-Gruppe signifikant stärker abnahmen als in der ALN-Gruppe, während sich bei den Frauen mit normalen Vitamin-D-Spiegeln keine Unterschiede zwischen ALN+VitD und ALN fanden. Die Autoren schliessen daraus, dass die Vitamin-D-Supplementation bei einer Behandlung mit Bisphosphonaten nicht zwingend ist, da Frauen mit einem normalen Vitamin-D-Spiegel nicht von der Supplementation profitieren. Hingegen ist bei Frauen mit einem Vitamin-D-Mangel der Rückgang der Knochenabbau-Marker um etwa 25% grösser, wenn zusätzlich zu den Bi-sphosphonaten auch Vitamin D gegeben wird.
Beeinflusst die Osteoporosetherapie die Frakturheilung?
Da Bisphosphonate und der monoklonale Antikörper den osteoklastischen Knochenabbau hemmen, könnte sich – aus theoretischen Überlegungen – ein frühzeitiger Beginn der Osteoporosebehandlung nach einer Fraktur ungünstig auf die Frakturheilung auswirken. Dass dem nicht so ist, zeigen zwei, Ende 2012 publizierte Studien.
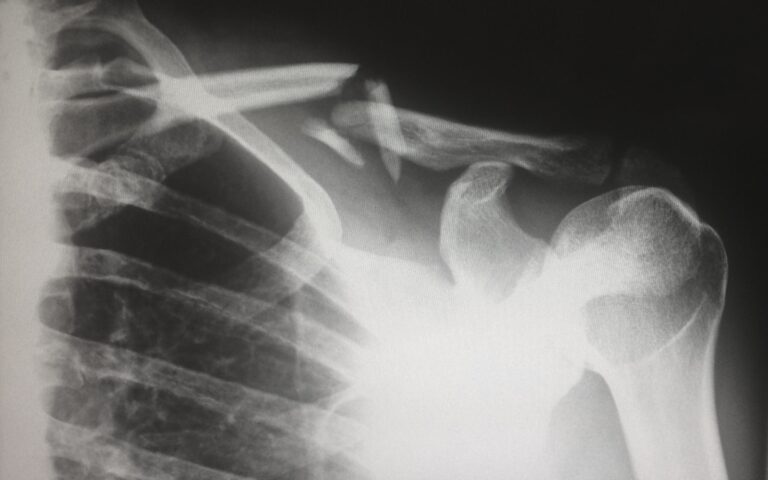
Gong et al. untersuchten 50 Frauen mit distaler Radiusfraktur, die osteosynthetisch behandelt werden mussten, und bei denen Osteoporose diagnostiziert wurde [4]. In Gruppe 1 wurde die Bisphosphonatbehandlung zwei Wochen postoperativ begonnen, in Gruppe 2 erst drei Monate postoperativ. Die klinischen und radiologischen Kontrollen zwei, sechs, zehn, 16 und 24 Wochen postoperativ zeigten bezüglich Frakturheilung keinerlei Unterschiede zwischen den beiden Gruppen. Aus diesem Grund empfehlen die Autoren dringend den frühzeitigen Beginn der Bisphosphonattherapie nach osteoporotischer Fraktur. In der geplanten Subgruppen-Analyse der placebokontrollierten 3-Jahres-FREEDOM-Studie, in welcher Denosumab bei postmenopausalen Frauen mit Osteoporose untersucht wurde, fanden sich 667 Patientinnen mit nichtvertebralen Frakturen [5]. Auch hier gab es bezüglich der Frakturheilung keine Unterschiede zwischen der Verum- und der Placebogruppe, woraus die Autoren schliessen, dass Denosumab in einer Dosis von 60 mg alle sechs Monate weder die Frakturheilung beeinträchtigt, noch zu vermehrten Komplikationen führt, auch nicht, wenn es zum Zeitpunkt der Fraktur oder kurz davor oder danach gegeben wird.
Da bei vielen Frauen die Osteoporose erst anlässlich einer Fraktur diagnostiziert wird, ist es besonders wichtig, dass die behandelnden Orthopäden diesen Frauen die nachgewiesenermassen wirksame Behandlung mit Denosumab oder einem Bisphosphonat nicht aus Angst vor einer Beeinträchtigung der Frakturheilung vorenthalten, sondern die medikamentöse Osteoporosebehandlung als festen Bestandteil der Frakturbehandlung betrachten.
Langzeittherapie
Die postmenopausale Osteoporose ist eine chronische Erkrankung und erfordert eine langfristige Behandlung, um das Frakturrisiko in Schach zu halten. Eine von der European Society for Clinical and Economic Aspects of Osteoporosis and Osteoarthritis (ESCEO) und der International Osteoporosis Foundation (IOF) durchgeführte Literaturübersicht zeigt, dass es erst wenige gute Studien gibt, die über die Langzeittherapie der Osteoporose Auskunft geben [6]. Folgende Ergebnisse fassen die Autoren zusammen:
- Kalzium und Vitamin D sind bezüglich Frakturprävention wirksam. Über Nutzen und Risiken nach drei Jahren kann aufgrund der heutigen Datenlage aber nichts gesagt werden.
- Für die selektiven Östrogen-Rezeptor-Modulatoren (SERM) kann über die Wirksamkeit bezüglich Frakturprävention nach mehr als fünf Jahren Behandlung nichts gesagt werden, hingegen scheint die Knochendichte kontinuierlich weiter zuzunehmen. Die Langzeitsicherheit der SERM ist gut, zudem schützen sie vor Mammakarzinom.
- Nachgewiesenermassen reduzieren Bisphosphonate während drei Jahren das Frakturrisiko, für Alendronat und Risedronat gibt es auch entsprechende 4- und 5-Jahresdaten. Die Knochendichte nimmt bei Fortführen der Therapie über mehr als fünf Jahre offenbar weiter zu. Die Sicherheit der Bisphosphonate scheint, mit Ausnahme der atypischen subtrochantären Femurfraktur, auch über längere Zeit gewährleistet zu sein.
- Für Denosumab gibt es 5-Jahres-Daten, die zeigen, dass der monoklonale Antikörper bei guter Sicherheit über die gesamte Zeit die Knochendichte stetig erhöht.
Behandlung der Kortikosteroid-induzierten Osteoporose
Die steroidinduzierte Osteoporose ist die häufigste sekundäre Form und die häufigste Osteoporoseform überhaupt bei jungen Erwachsenen. Der Knochenabbau beginnt bereits kurz nach Beginn der Steroidgabe und ist abhängig von der Dosis und der Dauer. Eine präventive Osteoporosebehandlung ist deshalb bei allen Patienten angezeigt, die eine tägliche Äquivalenzdosis von ≥7,5 mg Prednison über mindestens drei Monate erhalten. Nach heutiger Studienlage sind sowohl Bisphosphonate, als auch das anabole Parathormon Teriparatid dafür geeignet. Kalzium und Vitamin D sollten nur bei Mangelzuständen supplementiert werden. Allgemeine Osteoporose-Vorsorgemassnahme für Patienten, die eine mindestens dreimonatige Steroidtherapie beginnen, sind in Tabelle 1 zusammengefasst.
Eine finnische Gruppe untersuchte in einer doppelblind randomisierten, placebokontrollierten Studie die Wirksamkeit und Sicherheit von Ibandronat in der Prävention der steroidinduzierten Osteoporose bei postmenopausalen Frauen mit entzündlich-rheumatischen Erkrankungen [8]. In der Ibandronat-Gruppe war die Knochendichte der lumbalen Wirbelkörper sechs und zwölf Monate nach Therapiebeginn signifikant höher als zu Beginn, nach zwölf Monaten ebenso im Trochanter, im Schenkelhals und in der gesamten Hüfte. Gleichzeitig nahmen in der Verumgruppe im Vergleich zur Placebogruppe die Knochenabbau-Marker ab. Nebenwirkungen traten in beiden Gruppen gleich häufig auf, wobei unter Ibandronat der Anteil schwerer Nebenwirkungen etwas grösser war. Die einmal monatliche Verabreichung von oralem Ibandronat ist somit eine wirksame und sichere Massnahme zur Prävention einer Osteoporose bei postmenopausalen Frauen unter niedrigdosierten Steroiden.

Osteoporose bei Männern
Die Osteoporose stellt auch für den Mann einen wichtigen Grund für Morbidität und Mortalität dar. Weltweit sind 40% der über 50-Jährigen, die eine osteoporotische Fraktur erleiden, Männer. Zudem ist die Mortalität nach osteoporotischen Frakturen bei Männern höher als bei Frauen. Diese Zahlen zeigen, wie wichtig es ist, die Osteoporose-Medikamente auch bei Männern zu untersuchen. Boonen und Mitarbeiter führten zu diesem Zweck eine grosse, multizentrische, doppelblind randomisierte und placebokontrollierte Studie mit Zoledronsäure bei 1199 Männer im Alter von 50–58 Jahren, mit primärer oder mit Hypogonadismus-assoziierter Osteoporose, durch [9]. In der Verumgruppe lag die Rate neuer morphometrischer Wirbelfrakturen während der 24 Monate dauernden Studie bei 1,6%, in der Placebogruppe bei 4,9%. Dies entspricht einer Risikoreduktion von 67% unter Zole-dronsäure. Die Männer in der Verumgruppe erlitten auch signifikant weniger mittelschwere bis schwere Wirbelfrakturen und signifikant weniger Höhenminderungen als die Placebogruppe. Zudem traten in der Zoledronat-Gruppe tendenziell weniger klinische Wirbel- und Nicht-Wirbelfrakturen auf, der Unterschied zur Placebogruppe war aufgrund der kleinen Fallzahl aber nicht signifikant. Unter Zoledronsäure nahm die Knochendichte signifikant mehr zu und die Knochenabbau-Marker signifikant mehr ab als unter Placebo. Bezüglich Mortalität und schweren Nebenwirkungen fanden sich keine Unterschiede zwischen den beiden Gruppen. Zoledronsäure eignet sich also auch bei Männern mit Osteoporose dazu, das Frakturrisiko zu senken.

FAZIT FÜR DIE PRAXIS
- Patientinnen mit einem normalen Vitamin-D-Blutspiegel profitieren nicht zusätzlich, wenn die Bisphosphonate mit einer Vitamin-D-Supplementation ergänzt werden.
- Die Osteoporosetherapie (Bisphosphonate, monoklonale Antikörper) haben keinen negativen Einfluss auf die Frakturheilung, weshalb mit dem Beginn der Behandlung nach einer osteoporotischen Fraktur nicht zugewartet werden sollte.
- Patientinnen und Patienten, die über mindestens drei Monate niedrigdosierte Kortikosteroide erhalten, benötigen eine Osteoporoseprophylaxe.
- Die Osteoporose ist nicht nur ein Problem der menopausalen Frau. 40% der osteoporotischen Frakturen bei über 50-Jährigen betreffen Männer.
Literatur:
- Lippuner K, et al.: Remaining lifetime and absolute 10-year probabilities of osteoporotic fracture in Swiss men and women. Osteoporos Int 2010; 21: 381–3898.
- Rizzoli R, et al.: Osteoporose in der Schweiz im Jahr 2008: eine Aufforderung zur Tat. Schweiz Med Forum 2008; 8(Suppl.45): 1–11.
- Olmos JM, et al.: Effects of 25-hydroxyvitamin D3 therapy on bone turnover markers and PTH levels in postmenopausal osteoporotic women treated with alendronate. J Clin Endocrinol Metab 2012; 97: 4491–4497.
- Gong HS, et al.: Early initiation of bisphosphonate does not affect healing and outcomes of volar plate fixation of osteoporotic distal radial fractures. J Bone Joint Surg Am 2012; 94: 1729–1736.
- Adami S, et al.: Denosumab treatment in postmenopausal women with osteoporosis does not interfere with fracture-healing: results from the FREEDOM trial. J Bone Joint Surg Am 2012; 94: 2113–2119.
- Cooper C, et al.: Long-term treatment of osteoporosis in postmenopausal women: a review from the European Society for Clinical and Economic Aspects of Osteoporosis and Osteoarthritis (ESCEO) and the International Osteoporosis Foundation (IOF). Curr Med Res Opin 2012; 28: 475–491.
- Briot K, Roux C.: Ostéoporose cortico-induite. Rev Med Interne 2012. Epub ahead of print.
- Hakala M, et al.: Once-monthly oral ibandronate provides significant improvement in bone mineral density in postmenopausal women treated with glucocorticoids for inflammatory rheumatic diseases: a 12-month, randomized, double-blind, placebo-controlled trial. Scand J Rheumatol 2012; 41: 260–266.
- Boonen S, et al.: Fracture risk and zoledronic acid therapy in men with osteoporosis. N Engl J Med 2012; 367: 1714–1723.
Autoren
- Dr. med. Sabina M. Ludin
Publikation
- HAUSARZT PRAXIS