Beim HR-positiven metastasierten Brustkrebs gibt es mehrere neue Therapieoptionen. Ziel der alljährlichen Onkologie-Konferenz in St. Gallen war eine Einordnung und Beurteilung dieser Substanzen. Wie könnte ein moderner Therapiealgorithmus aussehen?
«Wenn wir in diesem Bereich von neuen Therapien sprechen, meinen wir damit vor allem Everolimus (Afinitor®), Palbociclib (Ibrance®), Ribociclib (Kisqali®) und Abemaciclib (noch nicht zugelassen in der Schweiz) – bis zu einem gewissen Grad auch noch Fulvestrant, das bereits Anfang der 2000er Jahre auf dem Markt erschien», so Dr. Müller. «Die Studien zu den Aromatasehemmern Letrozol und Anastrozol stehen exemplarisch dafür, was wir mit den älteren Medikamenten postmenopausal in der Erstlinie erreichten: Gegenüber Tamoxifen verlängerten sie das progressionsfreie Überleben signifikant und führten zu einem vergleichbaren oder höheren Ansprechen [1–3].»
In der FALCON-Studie [4] erwies sich Fulvestrant gegenüber Anastrozol in der Erstlinie als überlegen. Nach ca. sechs Monaten gingen die PFS-Kurven auseinander. Das Ansprechen war vergleichbar. Eine Subgruppenanalyse zeigte, dass insbesondere Patientinnen ohne viszeralen Befall länger progressionsfrei lebten (HR 0,59), während solche mit viszeralem Befall gegenüber Anastrozol nicht profitierten (HR 0,99).
Derzeit ist die endokrine Therapie für Östrogenrezeptor-positive fortgeschrittene Mammakarzinome die bevorzugte Option, auch bei viszeralen Metastasen (nur nicht bei «viszeraler Krise» oder vermuteter endokriner Resistenz – für diese Fälle sollte eine primäre Chemotherapie gewählt werden). Aus welchen Wirkstoffen und Kombinationen setzt sich die moderne endokrine Therapie aber vorzugsweise zusammen?
Problem: Resistenz
«Die Resistenzentwicklung auf endokrine Therapien ist in der metastasierten Situation unausweichlich», so der Referent. Von einer «primären Resistenz» spricht man, wenn der Tumor in weniger als einem halben Jahr unter endokriner Therapie progredient ist, von einer «sekundären» hingegen, wenn er erst nach diesem Zeitraum fortschreitet. Dies gilt für die primär metastasierte Situation.
Bei initial adjuvanter Situation bedeutet «primär resistent» ein frühes Rezidiv bis zu zwei Jahre nach Start der adjuvanten endokrinen Therapie. «Sekundär resistent» sind Tumoren, die erst nach zwei bis ca. sechs Jahren (unter ausgedehnter adjuvanter Therapie) rezidivieren, und als «sensitiv» gelten solche, die erst mindestens ein Jahr nach Ende der adjuvanten Therapie rezidivieren.
Die Resistenzmechanismen sind vielfältig. Häufig sind z.B. ER-Mutationen (aktivierende Mutation ESR-1). Solche sind erworben, treten bei 15–30% der vorgängig mit endokriner Therapie Behandelten auf und führen zu einer Resistenz gegenüber Tamoxifen, Aromatasehemmern und Fulvestrant (evtl. nicht gegenüber Fulvestrant-HD [5]). Weitere Resistenzmechanismen sind zelluläre Bypass-Signalübertragungswege.
Lösung: Neue Wirkstoffe
Für einige dieser Bypass-Wege gibt es inzwischen die genannten neuen Medikamente.
Everolimus beispielsweise zielt den Bypass via PI3K/AKT/mTOR-Signalweg an, indem es mTOR inhibiert. Als Serin-Threoninkinase besitzt mTOR eine Schlüsselfunktion in diesem Signalweg, der bekanntlich bei vielen humanen malignen Tumoren gestört ist. BOLERO-2 [6] zeigte in der Zweitlinie in Kombination mit Exemestan gegenüber Exemestan alleine eine signifikante Überlegenheit im primären Endpunkt PFS. Die Kurven gingen bereits nach ca. anderthalb Monaten auseinander und auch im Ansprechen spiegelte sich der Benefit wider. Kein signifikanter Effekt konnte im sekundären Endpunkt, dem Gesamtüberleben, nachgewiesen werden, wobei die Studie natürlich primär für PFS gepowert war. Eine störende und häufige Toxizität des Wirkstoffs ist die Stomatitis, die – wie der SWISH-Trial zeigte – mit Dexamethason-Mundspülung viermal täglich zumindest bis zu einem gewissen Grad kontrollierbar ist. Des Weiteren kann eine Pneumonitis auftreten, die bei mässigen und schweren Symptomen einen Therapieunterbruch bedingt. Insgesamt scheint die Lebensqualität durch den Wirkstoff zwar nicht relevant beeinträchtig, gegenüber Exemestan alleine allerdings auch nicht verbessert zu sein.
Ein anderes Wirkprinzip ist die CDK4/6-Hemmung. Der Cyclin D-CDK4/6-Komplex reguliert die Zellzyklusprogression über die Phosphorylierung des Retinoblastom(Rb)-Proteins. Die endokrine Resistenz ist assoziiert mit persistierender Cyclin D-Expression und Rb-Phosphorylierung. Selektive CDK4/CDK6-Kinase-Hemmer setzen genau an diesem Punkt an. In der PALOMA-3-Studie [7], die unter anderem am ASCO 2015 vorgestellt wurde, erwies sich Palbociclib in der Zweitlinie in Kombination mit Fulvestrant gegenüber Fulvestrant alleine als überlegen. Auch hier trennten sich die PFS-Kurven sehr früh (nach ca. anderthalb Monaten). Sieht man sich die Toxizität an, mag einen das Profil mit Neutropenie und Alopezie zunächst an die Chemotherapie erinnern. «Die Alopezie ist allerdings fast immer von Grad 1 und die Neutropenie unterscheidet sich klar von derjenigen bei Chemotherapie», erklärte der Redner. Hämatopoetische Stammzellen und frühe Neutrophilen-Vorläufer sind abhängig von der Cyclin D-CDK4/6-Aktivität, um in den Zellzyklus einzutreten, ihn zu durchlaufen und zu proliferieren. Während bei CDK4/CDK6-Kinase-Hemmern die Neutropenie also durch Zellzyklusarrest zustande kommt und sich somit im Verlauf meist eine rasche Erholung einstellt (nicht kumulativ), führt der DNA-Schaden und die Apoptose von proliferierenden Präkursoren bei Chemotherapie zu einer verzögerten Erholung. Grad 3/4-Neutropenien bei Palbociclib sind insofern kontrollierbar: Über zwei Drittel der Ereignisse treten im ersten Zyklus auf, nach Dosisreduktion ist das Risiko von schweren Neutropenien gering [8].
Und die Erstlinie?
MONALEESA-2 [9] bewies die Überlegenheit von Ribociclib mit Letrozol gegenüber Letrozol alleine in der Erstlinie (Risikoreduktion im primären Endpunkt PFS von über 40% sowie verbessertes Ansprechen). Die Resultate wurden flankiert von PALOMA-2 (Palbociclib) [10] und MONARCH-3 (Abemaciclib) [11] – die Wirkung der verschiedenen CDK4/CDK6-Kinase-Hemmer ist vergleichbar. Die Unterschiede zeigen sich vor allem im Toxizitätsprofil. Die häufigsten schweren unerwünschten Ereignisse waren in PALOMA-2 und MONALEESA-2 Neutropenien, daneben traten Alopezie, Fatigue und Anämie bei Palbociclib und zusätzlich Nausea bei Ribociclib auf. In MONARCH-3 war es vor allem die Diarrhö, nebst Fatigue und ebenfalls Neutropenie und Alopezie.
«Entsprechende Subgruppenanalysen zeigen, dass bisher keine klare klinische oder molekulare Patientengruppe identifiziert werden konnte, die nicht von den neuen Medikamenten profitiert. Es gibt also auch noch keine etablierten prädiktiven Biomarker», erläuterte Dr. Müller. «Bei älteren Frauen über 70 Jahre scheint die Wirksamkeit gleich zu sein. Die Tolerabilität ist hier allerdings – wie zu erwarten – deutlich schlechter.» Die Lebensqualität bei Palbociclib fällt in der Erstlinie zwar nicht schlechter, aber auch nicht besser aus als mit Letrozol alleine [12]. In der Zweitlinie ist hingegen die Kombination mit dem CDK4/6-Hemmer der Monotherapie mit Fulvestrant bezüglich Lebensqualität überlegen [13].
Wie entscheiden?
Nebst validen Biomarkern fehlten zum Zeitpunkt des Vortrags auch noch adäquat gepowerte OS-Daten zu den neuen zielgerichteten Wirkstoffen beim Hormonrezeptor-positiven metastasierten Brustkrebs – ebenso wie Studien zur optimalen Sequenz.
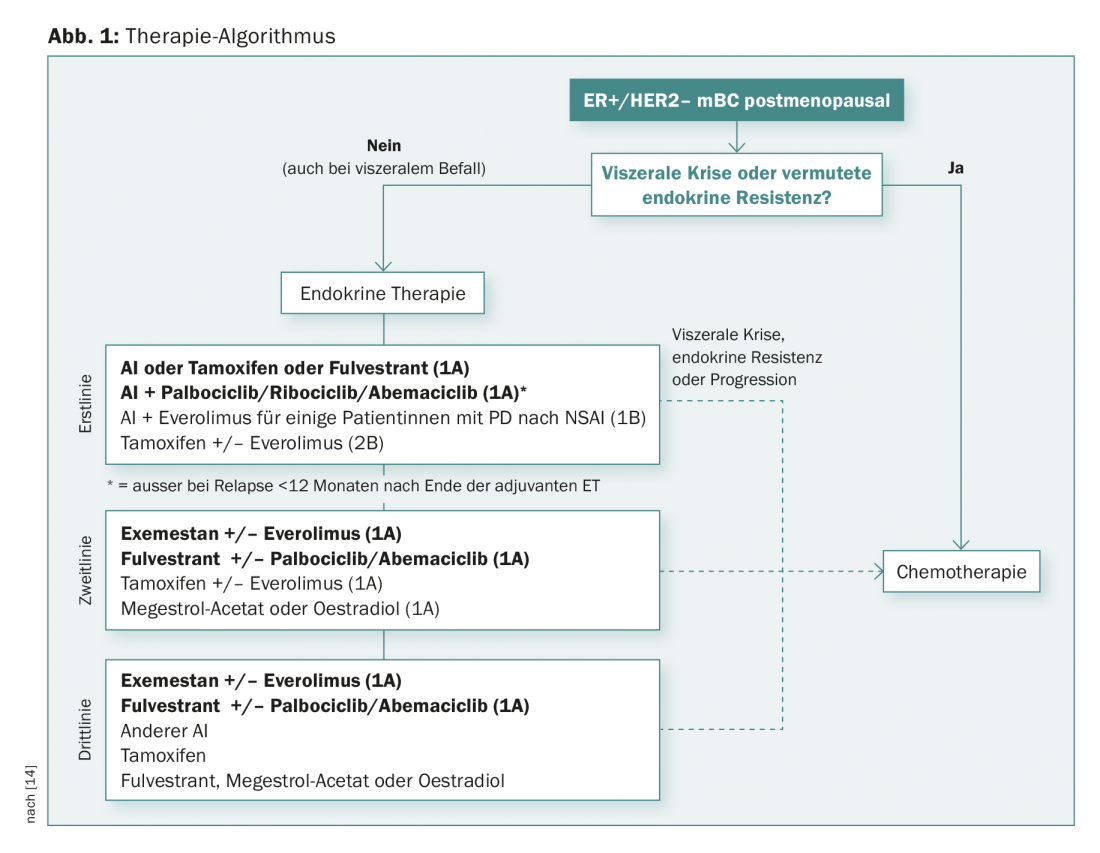
Ein möglicher Algorithmus für postmenopausale Patientinnen mit ER+/HER2- metastasierter Krankheit zeigt Abbildung 1. «Die endokrine Therapie alleine ist eine gute Option bei geringem Remissionsdruck. Die Kombination mit der CDK4/CDK6-Hemmung ist wirksam in der Erstlinie und auch später. Sie ist eine wichtige Option bei Remissionsdruck (auch bei Älteren mit allerdings mehr Toxizität). Everolimus und Exemestan sind wirksam nach Versagen einer endokrinen Therapie. ‹Wirksam› bedeutet bei den neuen Substanzen derzeit noch eine Verbesserung im PFS und Ansprechen (und noch nicht im OS)», fasste Dr. Müller das Ganze zusammen.
Quelle: 28. Ärzte-Fortbildungskurs in Klinischer Onkologie, 22.–24. Februar 2018, St. Gallen
Literatur:
- Mouridsen H, et al.: Phase III study of letrozole versus tamoxifen as first-line therapy of advanced breast cancer in postmenopausal women: analysis of survival and update of efficacy from the International Letrozole Breast Cancer Group. J Clin Oncol 2003 Jun 1; 21(11): 2101–2109.
- Nabholtz JM, et al.: Anastrozole (Arimidex) versus tamoxifen as first-line therapy for advanced breast cancer in postmenopausal women: survival analysis and updated safety results. Eur J Cancer 2003 Aug; 39(12): 1684–1689.
- Nabholtz JM, et al.: Anastrozole is superior to tamoxifen as first-line therapy for advanced breast cancer in postmenopausal women: results of a North American multicenter randomized trial. Arimidex Study Group. J Clin Oncol 2000 Nov 15; 18(22): 3758–3767.
- Robertson JFR, et al.: Fulvestrant 500 mg versus anastrozole 1 mg for hormone receptor-positive advanced breast cancer (FALCON): an international, randomised, double-blind, phase 3 trial. Lancet 2016 Dec 17; 388(10063): 2997–3005.
- Fribbens C, et al.: Plasma ESR1 Mutations and the Treatment of Estrogen Receptor-Positive Advanced Breast Cancer. J Clin Oncol 2016 Sep 1; 34(25): 2961–2968.
- Baselga J, et al.: Everolimus in postmenopausal hormone-receptor-positive advanced breast cancer. N Engl J Med 2012 Feb 9; 366(6): 520–529.
- Cristofanilli M, et al.: Fulvestrant plus palbociclib versus fulvestrant plus placebo for treatment of hormone-receptor-positive, HER2-negative metastatic breast cancer that progressed on previous endocrine therapy (PALOMA-3): final analysis of the multicentre, double-blind, phase 3 randomised controlled trial. Lancet Oncol 2016; 17(4): 425–439.
- Verma S, et al.: Palbociclib in Combination With Fulvestrant in Women With Hormone Receptor-Positive/HER2-Negative Advanced Metastatic Breast Cancer: Detailed Safety Analysis From a Multicenter, Randomized, Placebo-Controlled, Phase III Study (PALOMA-3). Oncologist 2016 Oct; 21(10): 1165–1175.
- Hortobagyi GN, et al.: Ribociclib as First-Line Therapy for HR-Positive, Advanced Breast Cancer. N Engl J Med 2016; 375: 1738–1748.
- Finn RS, et al.: Palbociclib and Letrozole in Advanced Breast Cancer. N Engl J Med 2016 Nov 17; 375(20): 1925–1936.
- Goetz MP, et al.: MONARCH 3: Abemaciclib As Initial Therapy for Advanced Breast Cancer. J Clin Oncol 2017 Nov 10; 35(32): 3638–3646.
- Rugo HS, et al.: Impact of Palbociclib Plus Letrozole on Patient Reported Health-Related Quality of Life: Results From the PALOMA-2 Trial. Ann Oncol 2018 Jan 19. doi: 10.1093/annonc/mdy012 [Epub ahead of print].
- Harbeck N, et al.: Quality of life with palbociclib plus fulvestrant in previously treated hormone receptor-positive, HER2-negative metastatic breast cancer: patient-reported outcomes from the PALOMA-3 trial. Ann Oncol 2016 Jun; 27(6): 1047–1054.
- Cardoso F, et al.: 3rd ESO-ESMO International Consensus Guidelines for Advanced Breast Cancer (ABC 3). Ann Oncol 2017 Jan 1; 28(1): 16–33.
InFo ONKOLOGIE & HÄMATOLOGIE 2018; 6(2): 38–40
Autoren
- Andreas Grossmann
Publikation
- INFO ONKOLOGIE & HÄMATOLOGIE




Comments are closed.