Im akuten Stadium der Virushepatitis ist das Krankheitsbild bei allen fünf Erregern ähnlich. HBV- und HCV-Infektionen sind weltweit die gefährlichsten chronischen Infektionskrankheiten. Im Gegensatz zu Hepatitis A und E prädisponieren Hepatitis B und C für eine chronische Hepatitis und Leberzellkarzinome. Hierzulande ist gegen Hepatitis A und B eine Impfung verfügbar. Gegen HCV, HDV und HEV steht in Europa aktuell kein Impfstoff zur Verfügung. Hepatitis C ist heutzutage mit antiviralen Medikamenten in über 95 Prozent der Fälle heilbar.
Bei der klassischen Virushepatitis handelt es sich um Leberentzündungen, die durch die Hepatitisviren A, B, C, D und E hervorgerufen werden. In der europäischen Region der Weltgesundheitsorganisation (WHO) sind jährlich rund 100’000 Todesfälle auf Virushepatitiden zurückzuführen [1]. Das ausschliesslich humanpathogene Hepatitis A-Virus (HAV) induziert meist nur akute Hepatitiden und ist primär in Entwicklungsländern verbreitet. Eine ähnliche Epidemiologie weist das Hepatitis E-Virus (HEV) auf, ist jedoch auch in Industrienationen weitverbreitet und kann zusätzlich eine chronische Erkrankung induzieren. Zu einer Chronifizierung kommen kann es ebenfalls bei dem weltweit verbreiteten Hepatitis B-Virus (HBV), dessen Satellitenvirus Hepatitis D (HDV) das kanzerogene Potenzial zusätzlich erhöht. Ebenfalls weltweit verbreitet ist das Hepatitis C-Virus (HCV), das ein hohes Chronifizierungsrisiko birgt und ebenfalls mit einem hohen kanzerogenen Potenzial einhergeht [2].
«Leberkrebs ist weltweit die dritthäufigste krebsbedingte Todesursache, und die wichtigsten modifizierbaren Risikofaktoren für primären Leberkrebs sind Infektionen mit dem Hepatitis -B- oder -C-Virus. Doch Hepatitis ist mit einem grossen Stigma behaftet, und dieses muss auf lokaler und nationaler Ebene und in der gesamten Europäischen Region bekämpft werden. Diese Stigmatisierung hält die Menschen oft davon ab, rechtzeitig Tests, Behandlung und Unterstützung in Anspruch zu nehmen, sodass der Infektionskreislauf fortbesteht und die Bemühungen der öffentlichen Gesundheitsdienste in den Bereichen Sexual- und Reproduktionsgesundheit, Schwangerenvorsorge, Untersuchung und Behandlung von Virushepatitis sowie Screenings auf Leberkrebs beeinträchtigt werden», konstatierte Dr. Hans Henri Kluge, WHO-Regionaldirektor für Europa [18].

Einige Manifestationen von akuter Hepatitis sind virusspezifisch, aber in der Regel werden die folgenden Phasen durchlaufen [3]:
- Inkubationsperiode: Das Virus multipliziert und verbreitet sich ohne Symptome zu verursachen.
- Prodromal- oder präikterische Phase: nichtspezifische Symptome wie Appetitlosigkeit, Krankheitsgefühl, Übelkeit und Brechreiz; eine neu aufgetretene Abneigung gegenüber Zigaretten (bei Rauchern); häufig Fieber oder Schmerzen im rechten Oberbauch; insbesondere bei der HBV-Infektion kommt es oft zu Urtikaria und Arthralgien.
- Ikterische Phase: Nach 3–10 Tagen wird der Urin dunkler, gefolgt von Gelbsucht. Die systemischen Symptome bilden sich meist zurück und der Patient fühlt sich besser, obwohl die Gelbsucht zunimmt. Die Leber ist meist vergrössert und druckschmerzhaft, die Leberränder bleiben weich und glatt. Bei 15–20% der Patienten tritt eine geringe Splenomegalie auf.
- Erholungsphase: Während dieses 2–4-wöchigen Zeitraums bilden sich die Symptome der Gelbsucht zurück. Eine spontane Heilung der akuten Virushepatitis erfolgt bei der Mehrheit der Patienten innerhalb von 4–8 Wochen nach dem Einsetzen der Symptome.
Ein vereinfachter diagnostischer Algorithmus bei Patienten mit Verdacht auf eine akute Virushepatitis ist in Abbildung 1 dargestellt [3].
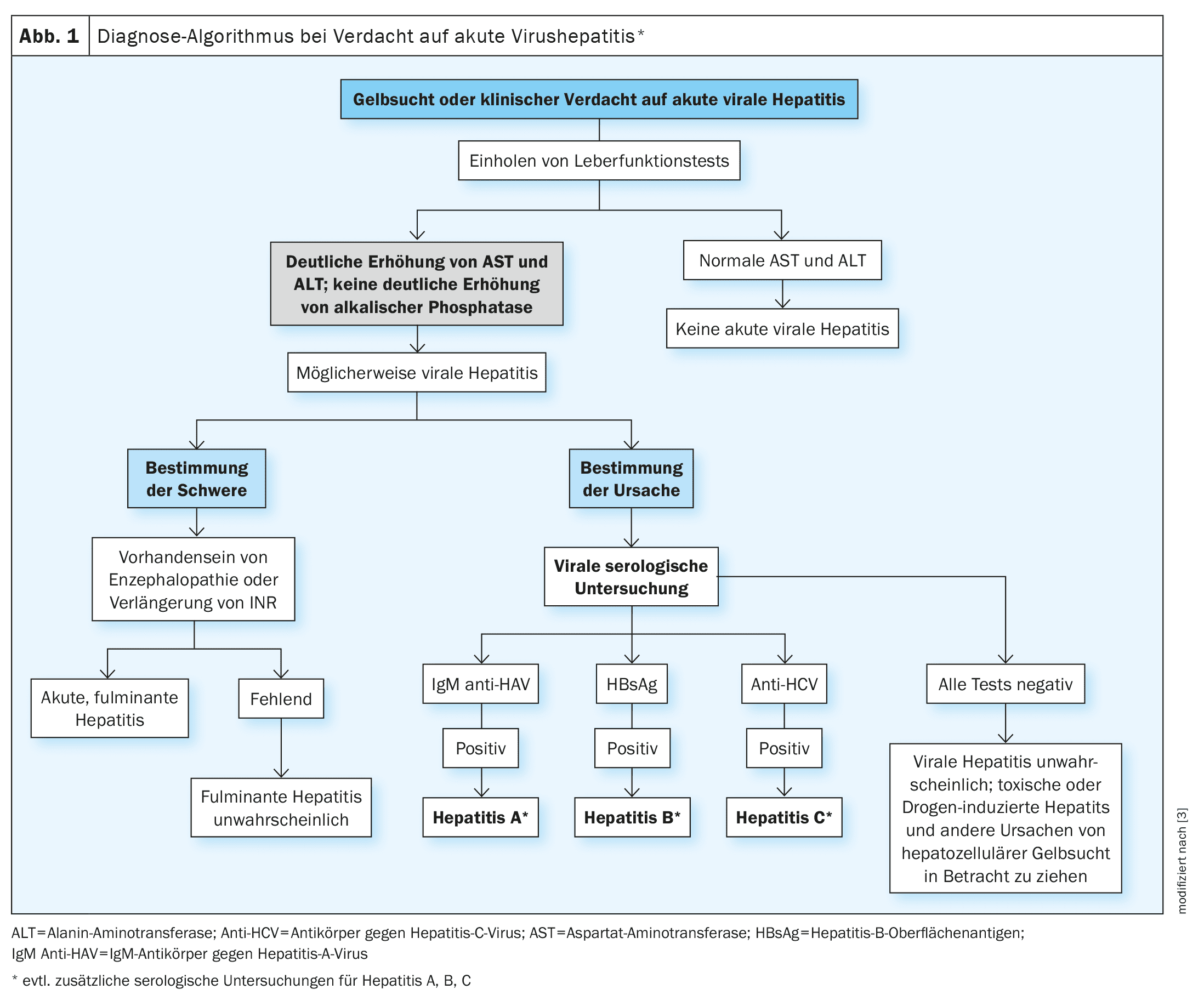
HBV: eine HDV-Koinfektion erhöht Risiko für schweren Verlauf
HBV ist vorwiegend in Entwicklungsländern (z.B. Südostasien, Afrika und Südamerika) endemisch mit Virusträgerraten von 5–10%. Neben der geografischen Verteilung hängt die Prävalenzrate von HBV auch vom Risikoverhalten ab [4]. HBV wird durch Kontakt mit Blut einer infizierten Person (z.B. Zahnbürste, Rasierapparat, Nadelstichverletzung) oder Sexualkontakt mit einer an Hepatitis B erkrankten Person übertragen.
Verlauf: Der klinische Verlauf ist hochvariabel und reicht von asymptomatisch, inapparent bis zu fulminanten und schweren Leberentzündungen. In 90% der Fälle heilt eine akute Hepatitis B-Infektion von selbst aus [5]. In Abhängigkeit von Alter, Immunstatus und weiteren Faktoren (z.B. Virusmutanten) geht die HBV-Infektion bei etwa 10% der akuten Fälle in eine chronische Form über [2,4]. Eine chronische Hepatitis ist eine der Hauptursachen für die Entwicklung einer Leberfibrose, einer Leberzirrhose und eines hepatozellulären Karzinoms (HCC).
Eine akute oder chronische HBV-Infektion kann mit einer HDV-Infektion einhergehen, man spricht in diesem Zusammenhang von Simultan- oder Superinfektion. Das sogenannte Satellitenvirus HDV repliziert nur in Anwesenheit von HBV [2]. Das Virus wurde erstmals 1977 als HBV-assoziiertes Antigen («Delta agent») beschrieben. Weltweit sind rund 5% der chronisch mit HBV infizierten Patienten mit HDV koinfiziert [6,7].
Eine HDV-Koinfektion erhöht das Risiko einer fulminanten Hepatitis stark. Während die HDV-Simultaninfektion in 95% der Fälle eliminiert werden kann, führt die Superinfektion eines HBV-Trägers mit HDV bei 80% der Infizierten zu einem chronischen Verlauf [2]. Dies erhöht die Wahrscheinlichkeit, eine Leberfibrose oder Leberzirrhose zu entwickeln, um das Zehnfache und verdreifacht das Risiko, an einem HCC zu erkranken [8]. Der HDV-Übertragungsweg entspricht demjenigen von HBV.
Therapie: Es gibt keine spezifischen Medikamente zur Behandlung einer akuten Hepatitis B. Hingegen kann die chronische Hepatitis B mit antiviral wirkenden Medikamenten oder mit pegyliertem Interferon- α behandelt werden [5]. Mit den zur Verfügung stehenden antiviralen Therapien kann die HBV-Viruslast gesenkt werden. Da das HBV nicht aus dem Körper eliminiert werden kann, muss die Behandlung zur Verhinderung der Virusvermehrung oft lebenslang beibehalten werden [9]. Patienten mit Leberzirrhose oder dauerhaft erhöhter Entzündungsaktivität haben ein erhöhtes Risiko ein HCC zu entwickeln und sollten entsprechend monitorisiert werden. Zur Behandlung der HDV wird teilweise pegyliertes Interferon-α eingesetzt, wobei es sich hierbei um eine off-label Therapie handelt [9]. Die erste und einzige seit Kurzem auch in der Schweiz zugelassene medikamentöse Behandlungsoption bei HDV ist Bulevirtid (Hepcludex®) [20]. Bulevirtid blockiert den Eintritt der HB- und HD-Viren in Hepatozyten, indem es an NTCP – einen Gallensalz-Lebertransporter, der als essentieller HBV/HDV-Eintrittsrezeptor dient – bindet und inaktiviert.
Impfung: Die Impfung schützt vor einer HBV-Infektion und bietet auch einen zuverlässigen Schutz gegen HDV. In der Schweiz empfiehlt das Bundesamt für Gesundheit (BAG) die Impfung bei 11 bis 15-Jährigen im Rahmen der Grundimmunisierung. Die Impfung kann im Erwachsenenalter nachgeholt werden. Kinder von HBV-positiven Müttern sollten nach Möglichkeit direkt nach der Geburt die erste Impfdosis erhalten [10]. Die Hepatitis-B-Impfung induziert anti-HBs-Antikörper, welche nahezu einen 100%-igen Impfschutz verleihen; ein Titer >100 IE gilt als sicher protektiv [9]. Die Hepatitis B-Impfung erfordert grundsätzlich drei Dosen (innerhalb eines halben Jahrs). Bei der Kombinationsimpfung mit Hepatitis A sind nur zwei Dosen notwendig, wenn die erste Injektion vor dem Alter von 16 Jahren durchgeführt wird. Beim Sechsfachimpfstoff für Säuglinge oder bei einem beschleunigten Impfschema (0, 1, 2, 12 Monate) sind jedoch vier Dosen erforderlich [19].
Hepatitis C ist heute gut behandelbar
HCV stellt, zusammen mit HBV, weltweit eine der Hauptursachen für akute und chronische Lebererkrankungen dar [2].
Verlauf: Akute HCV-Infektionen verlaufen meist asymptomatisch oder mit grippeähnlichen Symptomen, die bei etwa 15% der Erkrankten von selbst abheilen. In 60–85% der Fälle von HCV-Infektionen entwickelt sich eine chronische Hepatitis C. Aufgrund der HCV-induzierten Immunpathogenese kommt es zu einer Verminderung der Leberregeneration, was unbehandelt in der Ausbildung einer Leberfibrose/-zirrhose endet [11]. Bei etwa 15–20% der chronisch Erkrankten entwickelt sich nach 20–30 Jahren eine Leberzirrhose. Ausschlaggebend für die Progression der Leberzirrhose sind beispielsweise Geschlecht, genetische Faktoren, Alkoholkonsum, Fettleibigkeit und Insulinresistenz. Bei 2–4% der Patienten mit einer Leberzirrhose besteht das Risiko, an einem HCC zu erkranken [12].
Therapie: Eine HCV-Infektion ist heutzutage durch den Einsatz direkt wirkender antiviraler Medikamente (direct-acting antiviral agents, DAA) heilbar. Seitdem die DAA verfügbar sind, ist eine interferonbasierte Therapie überflüssig geworden [13]. Das Hauptziel der Behandlung einer chronischen HCV-Infektion ist die Eradikation des HCV. Eine Heilung der Virusinfektion im Sinne einer anhaltenden virologischen Reaktion, ist definiert als das Fehlen eines Virusnachweises im Blut 12 Wochen nach Beginn der Anti-HCV-Therapie. Patienten, die diesen Endpunkt erreichen, haben eine rund 99%-ige Chance, die Heilung aufrechtzuerhalten [14]. Die Substanzkombinationen sind in der Regel sehr gut verträglich [9].
Hepatitis A führt häufiger zu akuter Hepatitis als HEV
HAV und HEV werden grundsätzlich als selbstlimitierende, akute Hepatitiden eingestuft. Etwa 30% der <6-jährigen Kinder und 70% der Erwachsenen entwickeln eine akute Hepatitis A. Eine symptomatische Hepatitis E tritt nur in 5% aller Transmissionen auf [2].
Verlauf: In etwa 10–20% der Fälle einer akuten, selbstlimitierenden Hepatitis A kommt es im Verlauf zu einem Rezidiv. Akutes Leberversagen ist eine sehr seltene Komplikation einer HAV-Infektion (ca. 0,5–1% der symptomatischen Fälle), wobei insbesondere ältere multimorbide Menschen davon betroffen sind [15]. Ernsthafte Folgen im Kontext einer HEV-Infektion sind besonders für Schwangere und Immunsupprimierte beschrieben [16].
Therapie: Aktuell gibt es lediglich supportive Behandlungsmöglichkeiten einer akuten HAV-Infektion, eine antivirale Therapie ist bislang nicht verfügbar. Patienten mit hartnäckiger Übelkeit oder Erbrechen sowie Patienten, die Anzeichen von Leberversagen zeigen, sollten eingewiesen und engmaschig überwacht werden [17]. Auch HEV-Infektionen können lediglich supportiv behandelt werden.
Literatur:
- Inselspital Bern: Virale Hepatitis, www.leberzentrum-bern.ch/de/medizinisches-angebot-leber-gallenblase/lebererkrankungen/virale-hepatitis.html, (letzter Abruf 24.07.2024).
- Bender D, Glitscher M, Hildt E: Die Virushepatitiden A bis E: Prävalenz, Erregermerkmale und Pathogenese Bundesgesundheitsblatt Gesundheitsforschung Gesundheitsschutz 2022; 65(2): 139–148.
- «Überblick über die akute Virushepatitis», Sonal Kumar, MD, MPH, Weill Cornell Medical College, Überprüft/überarbeitet Aug. 2022, www.msdmanuals.com, (letzter Abruf 24.07.2024).
- Robert-Koch-Institut (RKI): Labor für Hepatitisvirus-Infektionen, www.rki.de/DE/Content/Institut/OrgEinheiten/Abt1/FG15/Labor_Hepatitisvirus.html, (letzter Abruf 24.07.2024).
- «Hepatitis behandeln», Hepatitis Schweiz, https://hepatitis-schweiz.ch/testen-und-behandeln/behandeln, (letzter Abruf 24.07.2024).
- WHO: Global hepatitis report, 2020.
- Zhang Z, Urban S: Interplay between Hepatitis D Virus and the Interferon Response. Viruses. 2020 Nov 20; 12(11): 1334.
- Turon-Lagot V, et al.: Targeting the Host for New Therapeutic Perspectives in Hepatitis D. J Clin Med 2020 Jan 14; 9(1): 222.
- Universitäts Spital Zürich (USZ): Virushepatitis Therapie, www.usz.ch/fachbereich/gastroenterologie-und-hepatologie/angebot/virushepatitis-therapie, (letzter Abruf 24.07.2024).
- «Hepatitis B», Amt für Gesundheit, Basel Landschaft, www.baselland.ch, (letzter Abruf 24.07.2024).
- Bender D, Hildt E: Effect of Hepatitis Viruses on the Nrf2/Keap1-Signaling Pathway and Its Impact on Viral Replication and Pathogenesis. Int J Mol Sci 2019 Sep 19; 20(18): 4659.
- Robert-Koch-Institut: Epidemiologisches Bulletin, 2021.
- Mehta P, Grant LM, Reddivari AKR: Viral Hepatitis. [Updated 2024 Mar 10]. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2024 Jan, www.ncbi.nlm.nih.gov/books/NBK554549, (letzter Abruf 24.07.2024).
- Simmons B, et al.: Risk of Late Relapse or Reinfection With Hepatitis C Virus After Achieving a Sustained Virological Response: A Systematic Review and Meta-analysis. Clin Infect Dis 2016; 62(6): 683–694.
- Shin EC, Jeong SH: Natural History, Clinical Manifestations, and Pathogenesis of Hepatitis A. Cold Spring Harb Perspect Med. 2018 Sep 4; 8(9): a031708.
- Lhomme S, et al.: Hepatitis E Pathogenesis. Viruses. 2016 Aug 5; 8(8): 212.
- Koenig KL, Shastry S, Burns MJ: Hepatitis A Virus: Essential Knowledge and a Novel Identify-Isolate-Inform Tool for Frontline Healthcare Providers. West J Emerg Med 2017; 18(6): 1000–1007.
- Weltgesundheitsorganisation: Welt-Hepatitis-Tag, www.who.int/europe/de/news/item/28-07-2023-world-hepatitis-day–reducing-the-risk-of-liver-cancer, (letzter Abruf 24.07.2024).
- «Hepatitis B», www.infovac.ch/de/impfunge/nach-krankheiten-geordnet/hepatitis-b, (letzter Abruf 24.07.2024).
- Swissmedic: Arzneimittelinformation, www.swissmedicinfo.ch, (letzter Abruf 25.09.2024)
HAUSARZT PRAXIS 2024; 19(8): 18–21
Autoren
- Mirjam Peter, M.Sc.
Publikation
- HAUSARZT PRAXIS


Comments are closed.